Одним из наиболее интересных и важных физико-химических явлений является реакция металлов с оксидами неметаллов. Данный процесс основан на взаимодействии металлических элементов и неметаллических оксидов, что приводит к образованию соответствующих соединений. Такая реакция имеет свои особенности и принципы взаимодействия, которые часто используются в промышленности и в научных исследованиях.
В основе реакции металлов с оксидами неметаллов лежит процесс окисления и восстановления. Металлы, обладающие высокой активностью, обычно способны вступать в реакцию с оксидами неметаллов, в результате чего происходит передача электронов от металла к оксиду. Металл при этом окисляется, а оксид неметалла восстанавливается.
Процесс реакции металлов с оксидами неметаллов часто сопровождается выделением тепла и образованием дополнительных продуктов. Это связано с тем, что при взаимодействии оксида с металлом происходит изменение энергетического состояния системы. Возможны различные исходы такой реакции, включая образование солей, оксидов металла и неметалла, а также выделение газов и образование воды.
Реакция металлов с оксидами неметаллов

Реакция металлов с оксидами неметаллов – это процесс, при котором металлы образуют соединения с оксидами неметаллов. Оксиды неметаллов являются основной формой оксигенации, поэтому их взаимодействие с металлами имеет важное значение.
Во время реакции металлы переходят из нейтрального состояния в положительно заряженное, образуя ион металла. В то же время, оксиды неметаллов получают электроны от металла и переходят в отрицательно заряженное состояние. Таким образом, реакция металлов с оксидами неметаллов является примером окислительно-восстановительной реакции.
Реакция металлов с оксидами неметаллов может иметь различные последствия. Некоторые металлы могут образовывать ионные соединения с оксидами неметаллов, при этом металл входит в состав положительного иона, а оксид неметалла – в состав отрицательного иона. Другие металлы могут образовывать совместные соединения с оксидами неметаллов, при этом электроны между металлом и оксидом неметалла распределяются не равномерно.
Взаимодействие металлов с оксидами неметаллов может иметь не только химические, но и физические последствия. Например, при реакции металлов с оксидами неметаллов может выделяться теплота или свет. Кроме того, реакция металлов с оксидами неметаллов может приводить к образованию новых веществ, которые могут быть использованы в различных областях науки и промышленности.
Принципы химического взаимодействия

Химическое взаимодействие между различными веществами основывается на определенных принципах. Одним из главных принципов является соответствие между реагентами и путем реакции достижения наилучшего равновесия.
Принцип усиления: для того чтобы реакция успешно прошла, необходимо создать условия, при которых процесс будет идти с наибольшей скоростью. Для этого можно использовать катализаторы, которые повышают скорость реакции.
Принцип сохранения массы: химическая реакция не может изменить общую массу реагентов и продуктов. Масса реагентов в системе должна быть равной массе продуктов.
Принцип сохранения энергии: энергия в системе также сохраняется. Энергия, выделяющаяся или поглощаемая в ходе химической реакции, должна быть вычислительно равной.
Принцип массовой доли: вещества реагируют между собой в определенных пропорциях, которые могут быть представлены в виде массовых долей. Это означает, что каждое вещество в реакции присутствует в определенной массовой пропорции.
Принцип постоянного состава: состав веществ, образующихся в результате химической реакции, не зависит от первоначального количества реагентов. Он определяется только их стехиометрическими коэффициентами.
Влияние электроотрицательности
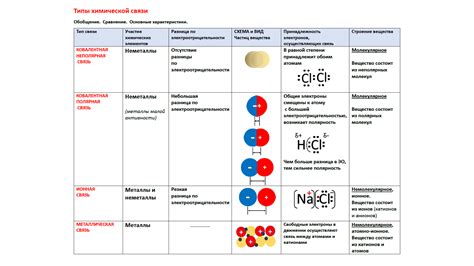
Влияние электроотрицательности на реакцию металлов с оксидами неметаллов основано на силе связи между атомами вещества. Электроотрицательность - это способность атома притягивать электроны в химической связи. Чем больше электроотрицательность атома, тем сильнее он притягивает электроны.
В реакции металлов с оксидами неметаллов, металл отдает электроны неметаллу, образуя положительный ион металла, а неметалл принимает электроны, образуя отрицательный ион оксида. Сила связи между атомами металла и атомами неметалла в оксиде определяется разностью электроотрицательности между ними.
При большой разности электроотрицательностей, положительно заряженный ион металла будет сильно притягивать отрицательно заряженные ионы оксида. Это будет способствовать образованию кристаллической решетки и стабильной связи между атомами. Следовательно, реакция металла с оксидом неметалла будет труднее происходить и может требовать дополнительных условий, таких как повышение температуры.
При малой разности электроотрицательностей, положительно заряженный ион металла будет слабо притягивать отрицательно заряженные ионы оксида. Это приведет к более слабой связи между атомами и облегчит реакцию металла с оксидом неметалла. Такие реакции часто проходят с высвобождением тепла и зачастую сопровождаются плавлением оксида и образованием металлического осадка.
Образование солей и области применения

Образование солей
Реакция металлов с оксидами неметаллов приводит к образованию солей. Процесс образования солей начинается с взаимодействия металла с оксидом неметалла. В результате реакции образуются ионные соединения, в которых положительные ионы металла соединяются с отрицательными ионами оксида неметалла. Таким образом, в реакции металл замещает водород, который присутствует в оксиде неметалла. Образовавшаяся соль может быть как растворимой в воде, так и нерастворимой.
Соли, полученные в результате реакций металлов с оксидами неметаллов, имеют широкий спектр применения в различных отраслях промышленности и научных исследованиях.
Области применения солей
- Производство удобрений. Некоторые соли, полученные из реакций металлов с оксидами неметаллов, используются в качестве компонентов удобрений, так как способствуют улучшению плодородия почвы и росту растений.
- Производство красителей. В некоторых отраслях промышленности, например в текстильной или пищевой, соли, получаемые из реакций металлов с оксидами неметаллов, используются в производстве красителей различных оттенков.
- Производство стекла. Определенные соли, полученные из реакций металлов с оксидами неметаллов, добавляются в процесс производства стекла для придания ему определенных свойств, таких как цветность или прозрачность.
- Производство лекарственных препаратов. Некоторые соли, получаемые в результате реакций металлов с оксидами неметаллов, используются в производстве лекарственных препаратов, так как обладают определенными свойствами, полезными для здоровья.
- Производство косметических средств. Различные соли, полученные из реакций металлов с оксидами неметаллов, используются в производстве косметических средств для достижения определенных эффектов или улучшения качества продукта.
Таким образом, образование солей в результате реакций металлов с оксидами неметаллов играет важную роль в различных отраслях промышленности и науке, обеспечивая получение продуктов со специфическими свойствами и широким спектром применения.
Вопрос-ответ

Какие металлы реагируют с оксидами неметаллов?
С реакцией металлов с оксидами неметаллов мы сталкиваемся ежедневно. К примеру, реакция металла калия с оксидом неметалла серы приводит к образованию сульфида калия. Однако не все металлы образуют с оксидами неметаллов реакционные продукты. Некоторые металлы, такие как золото и платина, обычно не реагируют с оксидами неметаллов.
Каковы основные принципы реакции металлов с оксидами неметаллов?
Реакция металлов с оксидами неметаллов основана на принципе окислительно-восстановительных реакций. Металл является восстановителем, то есть, он передает электроны оксиду неметалла, в результате чего образуется металлическая форма металла и окись неметалла. Процесс восстановления при реакции с оксидами неметаллов происходит путем выведения кислорода из оксида.
Каковы примеры реакции металлов с оксидами неметаллов?
Приведем несколько примеров реакции металлов с оксидами неметаллов. Реакция калия с оксидом серы приводит к образованию сульфида калия: 2K + SO2 -> K2S. Реакция натрия с оксидом азота приводит к образованию нитрида натрия: 3Na + N2O -> Na3N. Реакция магния с оксидом фосфора приводит к образованию фосфида магния: 3Mg + P2O5 -> Mg3P2.
Можно ли использовать результаты реакции металлов с оксидами неметаллов в промышленности?
Да, результаты реакции металлов с оксидами неметаллов могут быть использованы в промышленности. Например, реакция алюминия с оксидом кремния приводит к образованию кремния и алюминия, что позволяет получать сплавы с интересными свойствами, которые находят широкое применение в промышленности.
