Неорганические кислоты играют важную роль в химии и науке в целом. Одной из наиболее интересных областей их применения является взаимодействие с металлами. Это взаимодействие основывается на реакциях окисления-восстановления, которые позволяют получать соединения с различными свойствами и применениями.
Основным принципом взаимодействия металлов с неорганическими кислотами является образование солей. Соли представляют собой соединения, состоящие из положительных и отрицательных ионов, и образование этих соединений является результатом реакции металла с кислотой.
В реакции образуются ионы металла, которые играют роль положительных ионов соли. Кислота, в свою очередь, диссоциирует на ионы гидроксида или оксиды, которые играют роль отрицательных ионов соли. Таким образом, взаимодействие металла с кислотой приводит к образованию структуры соли, которая может иметь различные цвета, свойства и применения.
Взаимодействие металлов с неорганическими кислотами имеет широкое применение в различных отраслях науки и технологии. Например, металлы, образующие стойкие соли с кислотами, используются в качестве катализаторов в химической промышленности. Также, некоторые соли металлов с кислотами имеют важное значение в медицине и фармакологии. В области нанотехнологий активно изучается взаимодействие металлов с кислотами для создания новых материалов с уникальными свойствами.
Металлы и их свойства

Металлы - это класс элементов, характеризующихся высокой электропроводностью, теплопроводностью и металлическим блеском. Взаимодействие металлов с неорганическими кислотами, такими как соляная кислота, серная кислота и азотная кислота, основано на их химических свойствах и реакционной способности.
Одной из основных характеристик металлов является их активность, которая определяет их способность вступать в химические реакции. Активность металлов связана с их электрохимической реакцией с водой или кислотой. Более активные металлы, такие как натрий или калий, легко взаимодействуют с кислотами, освобождая водород и образуя соли. Наоборот, менее активные металлы, такие как медь или серебро, обычно не реагируют с кислотами.
Реакция металлов с неорганическими кислотами может приводить к образованию солей и выделению газов. Например, реакция цинка с соляной кислотой приводит к образованию хлорида цинка и выделению водорода. Реакция железа с серной кислотой может образовывать сульфат железа и высвобождать сернистый газ. Такие реакции широко используются в промышленности и лабораторных условиях для получения различных солей и используются для анализа и химических исследований.
Помимо реакций с кислотами, металлы также могут образовывать комплексы с неорганическими кислотами, такими как хлориды, сульфаты или нитраты. Эти комплексы имеют различные свойства и могут использоваться в различных областях, таких как катализ и лекарственная химия.
Неорганические кислоты и их роль
Неорганические кислоты – это класс химических соединений, которые обладают кислотными свойствами без участия органических компонентов. Они являются важными реагентами в различных химических процессах и находят широкое применение в промышленности, аналитической и органической химии.
Неорганические кислоты могут иметь различную степень кислотности в зависимости от концентрации и веществ, с которыми они взаимодействуют. Среди самых распространенных неорганических кислот можно выделить соляную, серную, азотную, хлористоводородную кислоты, а также фосфорную кислоту и многие другие.
Неорганические кислоты играют важную роль во многих химических реакциях, особенно взаимодействуют с металлами. Большинство металлов имеют способность реагировать с кислотами, что приводит к образованию солей и выделению газов. Некоторые металлы, такие как цинк и алюминий, способны реагировать с кислотами с выделением водорода. Другие металлы, например, железо и медь, способны образовывать соединения, которые растворяются в растворах кислот и образуют ионы металла и соответствующую кислоту.
Неорганические кислоты также используются для обработки металлических поверхностей, чтобы удалить окислительные покрытия и солевые отложения. Они также могут использоваться в процессах нанесения защитного покрытия на металл и при производстве металлических изделий. Кислоты вносят важный вклад в процессы обработки и преобразования материалов, играя решающую роль в химической промышленности и научных исследованиях.
Коррозия металлов в кислотах
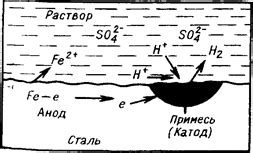
Коррозия металлов в кислотах – это процесс разрушения металлической поверхности под воздействием химических реакций с кислотным окружением. Кислоты содержат в своем составе ион водорода H+, который является активным окислителем. При контакте с металлом ионы водорода переносят электроны на поверхность металла, вызывая его окисление.
Коррозия металлов в кислотах может происходить различными механизмами в зависимости от химической природы кислоты и металла. Например, при взаимодействии неметаллических элементов, таких как азот или сера, с металлами, образуются соответствующие кислоты, которые активно коррозируют металлы.
Вода также может являться кислотой в определенных условиях, особенно если в ней содержатся растворенные газы или соли. Это может привести к образованию коррозионных процессов, например, образованию ржавчины на поверхности металла или образованию газов, таких как водород, который может вызвать разрушение металлической структуры.
Чтобы предотвратить коррозию металлов в кислотах, необходимо проводить меры по защите металлических конструкций. Одним из способов предотвращения коррозии является нанесение защитных покрытий на поверхность металла, таких как эмали, лаки или покрытия с использованием специальных растворов или пленок. Также можно применять антикоррозионные добавки, наносить защитные покрытия и проводить периодические обслуживание оборудования и инженерных систем.
Образование растворимых солей
Взаимодействие металлов с неорганическими кислотами может приводить к образованию растворимых солей. Растворимые соли обладают тем свойством, что они полностью диссоциируют в воде, образуя ионы металла и ионы кислоты. Это позволяет им легко растворяться в воде и образовывать стабильные растворы.
Образование растворимых солей основано на реакции обмена, при которой ионы металла вступают в реакцию с ионами кислоты. Реакция обмена может протекать по следующей схеме: металл + кислота → соль + водород. В результате образуется соль, которая диссоциирует в воде на ионы металла и ионы кислоты.
Образование растворимых солей зависит от ряда факторов, таких как химическая активность металла и кислоты, их концентрация, режим температуры и время взаимодействия. Например, активные металлы, такие как натрий и калий, реагируют с кислотами более интенсивно, чем менее активные металлы, такие как медь и свинец.
Образование растворимых солей находит широкое применение в различных отраслях промышленности и научных исследованиях. Растворимые соли используются как источник металлов для производства материалов, проведения химических реакций и изучения их свойств. Они также находят применение в медицине и пищевой промышленности, где служат добавками к препаратам и пищевым продуктам.
Образование нерастворимых осадков
Взаимодействие металлов с неорганическими кислотами может привести к образованию нерастворимых осадков. Это происходит, когда ионы металла вступают в реакцию с анионами из кислоты, образуя соединения, неспособные полностью раствориться в растворе.
Образование нерастворимых осадков может быть объяснено на основе ряда реакций, которые происходят между металлами и анионами из кислоты. При взаимодействии металла с кислотой, происходит образование комплексных ионов, которые могут быть нерастворимыми. Нерастворимость зависит от специфичных химических свойств металла и аниона, а также от условий, в которых происходит реакция.
Образование нерастворимых осадков может иметь важное значение при осаждении металлов из растворов. Этот процесс используется в различных областях, включая производство металлов, очистку воды и аналитическую химию. Образование осадков может быть полезным методом для удаления нежелательных металлов из растворов и очистки воды от загрязнений.
Для контроля образования нерастворимых осадков и определения их состава используются методы аналитической химии, такие как химический анализ и спектральные методы. Эти методы позволяют идентифицировать и количественно определить нерастворимые осадки, что важно для контроля качества и оптимизации процессов, где образуются осадки.
Применение в промышленности

Взаимодействие металлов с неорганическими кислотами имеет широкое применение в промышленности.
Один из основных способов использования этой реакции заключается в обработке металлов кислотами для очистки их поверхности от окислов и загрязнений. Зачастую этот процесс состоит из нескольких этапов, включающих обезжиривание металла и удаление нежелательных покрытий. Очищенный металл становится готовым для последующей обработки и использования в производственных целях.
Еще одним примером применения взаимодействия металлов с неорганическими кислотами является электрохимическая обработка. В этом процессе металл погружается в раствор кислоты, который придает ему определенные свойства, такие как устойчивость к коррозии или повышенная проводимость. Электрохимическая обработка используется, например, для производства гальванических покрытий, а также для создания электролитических батарей и аккумуляторов.
Также стоит отметить использование этого взаимодействия в процессе производства удобрений. Многие удобрения производятся из неорганических кислот и металлических соединений. Например, в процессе производства азотной кислоты используется взаимодействие аммиака с платиновым катализатором, что позволяет получить важное удобрение для сельского хозяйства.
Таким образом, применение взаимодействия металлов с неорганическими кислотами в промышленности является неотъемлемой частью многих процессов производства. Это позволяет очистить поверхность металла, придать ему нужные свойства и получить необходимые продукты для различных отраслей промышленности.
Вопрос-ответ

Какие металлы образуют соли с неорганическими кислотами?
Металлы, образующие соли с неорганическими кислотами, включают широкий спектр элементов, таких как натрий, калий, кальций, железо, медь, цинк и другие. Эти металлы способны образовывать ионы в реакции с кислотой, которые затем образуют соли.
В чем заключаются основные принципы взаимодействия металлов с неорганическими кислотами?
Основными принципами взаимодействия металлов с неорганическими кислотами являются образование солей и выделение водорода. Когда металл взаимодействует с кислотой, происходит образование иона металла, который соединяется с анионом кислоты, образуя соль. При этом происходит выделение молекулы водорода.
