Взаимодействие металлов с неметаллами – это процесс химической реакции, в результате которого образуются соединения между атомами металла и неметалла. Эта тема имеет большое значение в химии и материаловедении, поскольку позволяет понять, как образуются и свойства многочисленных соединений в природе и промышленности.
Основным различием между металлами и неметаллами является принципиальная разница в строении атомов и их электронной структуре. Металлы обладают низкой электроотрицательностью и обычно имеют от одного до трех электронов во внешней оболочке. В свою очередь, неметаллы обладают высокой электроотрицательностью и обычно имеют от трех до восьми электронов во внешней оболочке. Это различие в электронной структуре становится основой для различных типов взаимодействий между металлами и неметаллами.
Одним из типичных примеров взаимодействия металлов с неметаллами является образование ионных соединений. В этом случае, металл отдает одно или несколько электронов неметаллу, образуя положительно заряженные ионы металла и отрицательно заряженные ионы неметалла. Такие соединения обычно обладают прочными и хрупкими кристаллическими структурами и имеют высокую температуру плавления и кипения. Они характеризуются также химической инертностью и обычно образуют растворы с проводимостью электричества.
Металлы и неметаллы: принципы взаимодействия

Металлы и неметаллы - это различные классы элементов, обладающие разными физическими и химическими свойствами. Взаимодействие между ними основывается на принципах, которые определяются их строением и электрохимическими свойствами.
Металлы обычно обладают низкой электроотрицательностью и образуют ионы с положительным зарядом. Неметаллы, в свою очередь, имеют высокую электроотрицательность и образуют отрицательно заряженные ионы. При взаимодействии между ними происходит передача электронов от металла к неметаллу, что приводит к образованию ионов и образцуется ионной связью.
Также металлы и неметаллы могут взаимодействовать в химических реакциях, образуя химические соединения. В таких реакциях металл отдает электроны неметаллу, образуя ионы металла с положительным зарядом, а неметалл получает электроны, образуя ионы с отрицательным зарядом. Такие соединения обычно обладают ионной или ковалентной связью.
Важно отметить, что не все металлы и неметаллы могут взаимодействовать между собой. Некоторые металлы слишком реакционны и могут растворяться в неметаллах, например, активные металлы, такие как натрий и калий, реагируют с водой с выделением водорода и образуют гидроксиды. Неметаллы также могут образовывать соединения только с определенными металлами, их активность может зависеть от конкретных условий.
Свойства металлов и неметаллов

Металлы и неметаллы - две основные категории химических элементов. У них есть ряд основных отличительных свойств, которые определяют их поведение и взаимодействие с другими элементами и соединениями.
Одним из основных свойств металлов является их способность проводить электричество и тепло. В отличие от неметаллов, металлы обладают свободными электронами, которые могут перемещаться по металлической решетке, образуя электрический ток. Это свойство делает металлы отличными проводниками электричества и тепла.
Еще одним важным свойством металлов является их блеск. Металлы имеют металлическую глянцевую поверхность, которая отражает свет, создавая эффект блеска. Это свойство связано с электронной структурой металлов и их способностью поглощать и отражать электромагнитные волны света.
Неметаллы, в отличие от металлов, обычно не проводят электричество. Это связано с их электронной структурой, которая не позволяет электронам свободно двигаться внутри материала. Неметаллы также являются хорошими изоляторами тепла. Они не позволяют энергии перемещаться через них, что делает их хорошими теплоизоляционными материалами.
Однако, не все неметаллы обладают одинаковыми свойствами. Некоторые неметаллы могут быть твердыми и хрупкими, такими как сера и фосфор, а некоторые могут быть газообразными, например, кислород и азот. Кроме того, некоторые неметаллы обладают ярко выраженной химической активностью и могут образовывать различные соединения с металлами и другими неметаллами.
Электроотрицательность и связывание
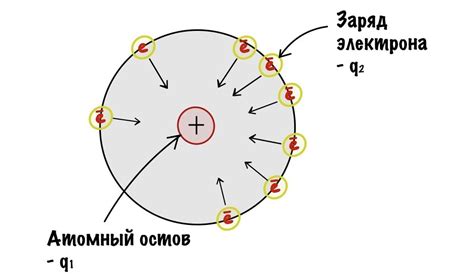
Электроотрицательность - это физическая характеристика атома, которая определяет его способность притягивать электроны в химических связях. Чем выше электроотрицательность атома, тем сильнее он притягивает электроны.
При взаимодействии металлов с неметаллами электроотрицательность играет важную роль. Металлы обычно имеют меньшую электроотрицательность, а неметаллы - большую. Поэтому при связывании атомы неметаллов захватывают электроны от атомов металлов, образуя ионные или ковалентные связи.
Ионное связывание возникает, когда атом металла отдает электрон(ы) атому неметалла. В результате образуется положительный ион (катион) и отрицательный ион (анион), которые притягиваются друг к другу электростатическими силами. Примером такого связывания может служить реакция натрия (Na) с хлором (Cl), при которой образуется ионный кристалл - хлорид натрия (NaCl).
Ковалентное связывание - это связь, образованная общими электронами между атомами неметаллов. В этом случае атомы неметаллов «делят» электроны, создавая общие пары электронов, которые связывают атомы в молекулы или кристаллическую решетку. Примерами ковалентного связывания являются связи в молекуле воды (H2O) или в молекуле метана (CH4).
Формирование ионных соединений
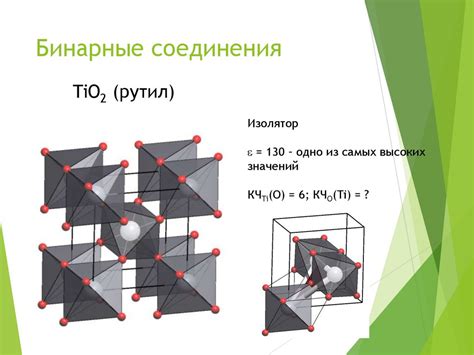
Ионные соединения образуются при взаимодействии металлов с неметаллами. В ходе реакции металл отдаёт электроны, становится положительно заряженным ионом (катионом), а неметалл получает электроны, становится отрицательно заряженным ионом (анионом). Эти противоположно заряженные ионы притягиваются друг к другу электростатическими силами, образуя ионное соединение.
В ионных соединениях металлы, как правило, отдают один или несколько электронов из своей внешней электронной оболочки, образуя ионы положительной зарядности. Неметаллы же, наоборот, принимают эти электроны, так как они имеют недостаток внешних электронов. В результате этого металлы превращаются в положительные ионы, а неметаллы - в отрицательные ионы.
Образовавшиеся катионы и анионы объединяются в соединение, соблюдая электрическую нейтральность. Чтобы уравновесить положительный ион, требуется соединить его с отрицательным ионом так, чтобы заряды сбалансировались. Так, на один ион негативной зарядности должен приходиться один ион позитивной зарядности, чтобы получилось электрически нейтральное вещество.
Примеры ионных соединений: хлорид натрия (NaCl), оксид кальция (CaO), нитрат аммония (NH4NO3) и др. Такие соединения обладают высокой термической и электрической стабильностью, образуют кристаллические решётки и имеют характерные физические и химические свойства.
Образование ковалентных связей
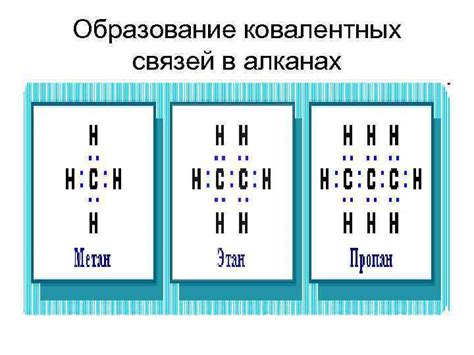
Ковалентная связь - это химическая связь, которая образуется при взаимодействии атомов неметаллов. Она основывается на общем использовании электронов внешней оболочки атомов. Атомы, образующие ковалентную связь, делят друг с другом электроны, чтобы заполнить свои внешние оболочки и достичь более устойчивого состояния.
Ковалентные связи между атомами образуются путем совместного использования их электронных оболочек. Когда два атома объединяются, их электронные облака перекрываются, и электроны начинают двигаться вокруг обоих атомов. Это создает область общей электронной плотности, называемую связующей областью.
В ковалентной связи различают два основных типа: полярные и неполярные. В полярной ковалентной связи электроны проводимости обнаруживают большую вероятность находиться около одного из атомов, создавая разность зарядов между ними. В неполярной ковалентной связи электроны проводимости равномерно распределены между атомами, и разность зарядов отсутствует.
Образование ковалентных связей обусловлено электронной структурой атомов. Атомы стараются заполнить свои внешние электронные оболочки, а общее использование электронов позволяет им достичь этой цели. Ковалентные связи обладают различными свойствами, которые определяют их химическую реактивность и физические характеристики веществ.
Полярность связей и молекулы
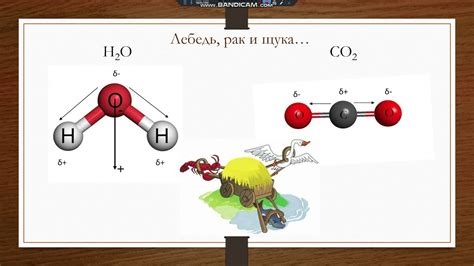
Полярность связей и молекулы - это свойство, которое определяет распределение зарядов в молекуле. Оно возникает из-за неравномерного распределения электронной плотности и отличия в электроотрицательности атомов, участвующих в связи. Полярность связей определяется разностью электроотрицательностей атомов, причем электронный грешок принадлежит атому с большей электроотрицательностью.
Молекула может быть как полярной, так и неполярной в зависимости от суммарной полярности связей в ней и их ориентации. Полярная молекула имеет дипольный момент, то есть разделение положительного и отрицательного зарядов. Неполярная молекула, в свою очередь, не имеет дипольного момента, так как заряды в ней равномерно распределены.
Полярность молекулы определяет множество ее свойств и способность к взаимодействию с другими веществами. Так, полярные молекулы имеют большую растворимость в полярных растворителях, а неполярные молекулы наоборот - в неполярных растворителях.
Полярные связи и молекулы играют важную роль в химических реакциях и процессах, особенно при взаимодействии металлов с неметаллами. Это связано с тем, что полярные связи могут образовывать ионные связи и проводить электрический ток, что приводит к возникновению различных химических реакций и образованию новых соединений.
Металлы как катализаторы реакций
Катализаторы – важные вещества, которые существенно ускоряют химические реакции, не вмешиваясь при этом в сами реакции и оставаясь почти неизменными в конце процесса. Металлы являются одними из самых распространенных и эффективных катализаторов.
Одно из объяснений этого феномена связано с особыми свойствами металлов. Они обладают высокой электропроводностью и способностью образовывать различные ионы, что позволяет им принимать активное участие в химических реакциях. Благодаря своей структуре, металлы также обладают большой поверхностью, что способствует увеличению контакта с реагентами и, соответственно, ускоряет реакцию.
Кроме того, металлы могут образовывать различные соединения и комплексы с другими химическими веществами, что также способствует ускорению процессов реакции. Иногда металлы действуют как источники электронов, что позволяет активировать реагенты и образовывать промежуточные соединения, участвующие в реакции.
Катализаторы на основе металлов используются во множестве промышленных процессов, таких как синтез аммиака, производство полимеров и нефтехимические реакции. Они обладают высокой активностью, эффективностью и стабильностью. Кроме того, металлические катализаторы могут быть использованы повторно, что делает их экономически выгодными.
В итоге, использование металлов как катализаторов позволяет значительно снизить энергозатраты и повысить скорость процессов реакций. Данная область катализа постоянно развивается и исследования в этой области металлургии позволят нам использовать эффективные и экологически чистые методы в различных отраслях промышленности.
Реакции металлов с неметаллами

Металлы и неметаллы являются основными компонентами химических реакций, происходящих в природе и промышленности. Их взаимодействие часто приводит к образованию различных химических соединений, которые имеют широкий спектр применения.
Реакция металла с неметаллом может быть представлена как передача электронов от металла к неметаллу, что приводит к образованию ионов и образованию ионических соединений. Например, при взаимодействии натрия (металла) с хлором (неметалла) образуется хлорид натрия.
С другой стороны, реакция металла с неметаллом может также происходить по механизму совместного использования электронов, что приводит к образованию ковалентных соединений. Например, взаимодействие углерода (неметалла) и железа (металла) приводит к образованию соединения - железоуглерода.
Важно отметить, что химическая реакция взаимодействия металлов с неметаллами может происходить различными способами, включая сжигание, окисление, восстановление и замещение. Например, реакция металла с кислородом приводит к образованию оксидов металлов, а реакция металла с кислотой приводит к образованию солей и выделению водорода.
Кроме того, взаимодействие металлов с неметаллами может быть существенно повышено при наличии катализаторов, которые ускоряют химическую реакцию. Например, в промышленности широко используется катализатор, такой как платина, при производстве аммиака из азота и водорода.
Вопрос-ответ

Какие общие свойства металлов и неметаллов определяют их взаимодействие?
Общие свойства металлов и неметаллов, определяющие их взаимодействие, включают электроотрицательность, способность к образованию связей их атомов, теплоемкость, плотность и электропроводность.
Какие физические свойства металлов и неметаллов влияют на их взаимодействие?
Физические свойства металлов и неметаллов, такие как точка плавления и кипения, твердость, пластичность и магнитные свойства, определяют их способность взаимодействовать друг с другом.
