Взаимодействие металлов с неметаллами является одной из основных тем в химии. Это явление имеет огромное значение в промышленности, научных исследованиях и повседневной жизни. Понимание процессов, происходящих при взаимодействии металлов и неметаллов, помогает разрабатывать новые материалы, обеспечивающие безопасность и экономичность производства, а также способствующие экологической чистоте.
Во время взаимодействия металлов и неметаллов происходит перенос электронов между атомами. Этот процесс может протекать с разной интенсивностью и способствовать образованию новых химических соединений. Разные металлы и неметаллы имеют разные свойства, поэтому они реагируют с ними по-разному. Некоторые металлы обладают химической активностью и могут легко вступать в реакции с неметаллами, тогда как другие металлы являются химически инертными и слабо взаимодействуют с неметаллами.
Основными особенностями взаимодействия металлов с неметаллами являются образование ионных соединений и образование новых веществ с совершенно новыми свойствами. Во время ионного взаимодействия металл отдает электроны и становится положительно заряженным ионом, а неметалл принимает электроны и становится отрицательно заряженным ионом. В результате образуются устойчивые соединения, в которых электрическая нейтральность сохраняется. Эти соединения обладают определенными физическими и химическими свойствами, которые определяют их применение в различных областях науки и техники.
Роль металлов и неметаллов в химических реакциях

Металлы и неметаллы играют важную роль в химических реакциях, так как их взаимодействие позволяет образовать различные соединения и реакции с разнообразными свойствами.
Металлы обладают хорошей проводимостью электричества и тепла, они также обычно обладают блестящей поверхностью и хорошей пластичностью. Металлы имеют способность отдавать электроны, образуя положительно заряженные ионы (катионы) в химических реакциях.
Неметаллы, напротив, обычно не обладают проводимостью электричества и имеют газообразное или твердое состояние при комнатной температуре. Они имеют свойство принимать электроны, образуя отрицательно заряженные ионы (анионы) в химических реакциях.
Металлы и неметаллы активно взаимодействуют друг с другом, образуя различные химические соединения. Металлы, благодаря своей способности отдавать электроны, реагируют с неметаллами, принимающими электроны, и образуют ионные соединения. При этом металлы обычно выступают в качестве окислителей, а неметаллы - в качестве восстановителей.
Взаимодействие металлов и неметаллов не ограничивается только ионными реакциями. Они также могут реагировать между собой посредством обмена электронами, образуя ковалентные соединения. Такие реакции обычно происходят между неметаллами или между неметаллами и полуметаллами. В результате таких реакций образуются молекулы, в которых электроны между атомами общие.
В целом, металлы и неметаллы играют важную роль в химических реакциях, образуя разнообразные соединения с различными свойствами. Изучение и понимание взаимодействия металлов и неметаллов позволяет углубить наши знания о различных химических процессах и материалах, и применить их в различных областях науки и технологий.
Важность химического взаимодействия

Химическое взаимодействие является основой множества процессов в природе и технологии. Оно позволяет элементам и соединениям образовывать новые вещества с уникальными свойствами.
Химическое взаимодействие между металлами и неметаллами играет важную роль в создании различных материалов. Например, соединение металла и неметалла может привести к образованию керамики, которая обладает высокой прочностью и теплоизоляцией.
Кроме того, химическое взаимодействие определяет характер атомарной связи в молекулах. Взаимодействие между атомами различных элементов может быть ковалентным или ионным, что влияет на их химические и физические свойства. Например, ионная связь между металлом и неметаллом обеспечивает высокую электропроводность, тогда как ковалентная связь позволяет образовывать молекулы с определенной формой и свойствами.
Понимание химического взаимодействия между металлами и неметаллами позволяет улучшить существующие материалы и разработать новые соединения с уникальными свойствами. Например, изучение взаимодействия металлов с кислородом привело к разработке высокопрочных сплавов с повышенной коррозионной стойкостью и низким весом.
Различия между металлами и неметаллами

Металлы и неметаллы - два основных класса химических элементов, которые имеют существенные различия в своих физических и химических свойствах.
Во-первых, металлы обладают высокой электропроводностью, в то время как неметаллы являются плохими проводниками электричества. Это связано с различием в электронной структуре атомов этих элементов. В металлах электроны легко передвигаются по всей структуре, в то время как в неметаллах они сильно связаны с атомами и не могут легко переходить от одного атома к другому.
Во-вторых, металлы обычно обладают блестящим металлическим блеском, когда их поверхность полирована. Они также обладают высокой плотностью и твердостью. Неметаллы, напротив, имеют скорее матовую поверхность и часто мягкие и хрупкие свойства.
В-третьих, металлы обладают высокой теплопроводностью и температуроустойчивостью, в то время как неметаллы плохо проводят тепло и имеют низкую температуроустойчивость.
Кроме того, металлы обычно имеют высокую плотность и тяжелы на ощупь, в то время как неметаллы часто легкие и имеют более низкую плотность.
Таким образом, различия между металлами и неметаллами включают электропроводность, внешний вид, твердость, теплопроводность и плотность. Эти различия являются основой для их различных химических и физических свойств и проявляются в их взаимодействии друг с другом.
Фичи химического взаимодействия
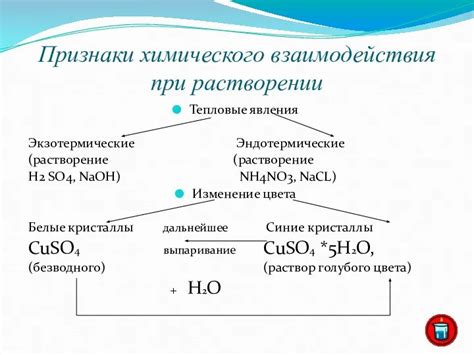
Химическое взаимодействие — это процесс, в результате которого происходит образование новых веществ путем изменения химической структуры и свойств исходных веществ. Этот процесс может происходить как между металлами и неметаллами, так и между неметаллами между собой.
Одна из особенностей химического взаимодействия металлов с неметаллами заключается в том, что металлы склонны отдавать электроны, образуя положительно заряженные ионы, а неметаллы, наоборот, склонны принимать электроны, образуя отрицательно заряженные ионы. Это обусловлено различной электроотрицательностью металлов и неметаллов.
Другой фичей химического взаимодействия металлов с неметаллами является образование ионных связей. При этом, между положительно заряженными ионами металлов и отрицательно заряженными ионами неметаллов возникают притяжительные силы, которые держат атомы вещества вместе.
Еще одной особенностью взаимодействия металлов с неметаллами является возможность образования различных химических соединений. Например, при взаимодействии металла натрия (Na) и неметалла хлора (Cl) образуется хлорид натрия (NaCl) — химическое соединение, состоящее из атомов натрия и хлора, связанных ионными связями.
Таким образом, химическое взаимодействие металлов с неметаллами обладает рядом фичей, включающих возможность передачи электронов, образование ионных связей и образование различных химических соединений. Эти фичи определяют особенности химических реакций и свойств получаемых в результате соединений.
Окислительно-восстановительные реакции
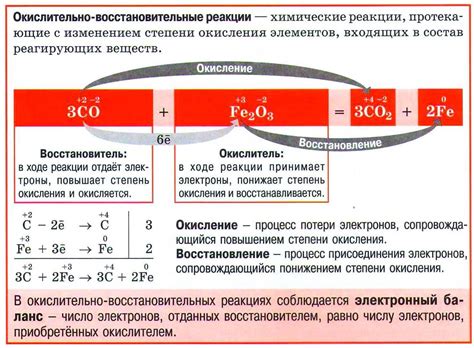
Окислительно-восстановительные реакции представляют собой важный вид химических реакций, при которых происходит перенос электронов между веществами. В таких реакциях одно вещество окисляется (потеряет электроны), а другое вещество восстанавливается (получает электроны).
Взаимодействие металлов с неметаллами часто сопровождается окислительно-восстановительными реакциями. Например, при реакции металла с кислородом происходит окисление металла, а кислород восстанавливается. Подобные реакции сопровождаются выделением тепла и света.
Для проведения окислительно-восстановительных реакций обычно используют специальные вещества, называемые окислителями и восстановителями. Окислитель обладает большей способностью получать электроны, тогда как восстановитель способен отдавать электроны. В результате, электроны переносятся от окислителя к восстановителю.
Окислительно-восстановительные реакции играют важную роль в различных процессах, включая горение, коррозию металлов, электролиз и многие другие. Понимание этих реакций позволяет управлять химическими процессами и применять их в разных сферах науки и техники.
Комплексообразование

Комплексообразование представляет собой процесс образования комплексных соединений между металлами и неметаллами. Оно основывается на взаимодействии электронов валентной оболочки металла с электронной оболочкой неметалла. В результате такого взаимодействия образуется химическая связь между атомами металла и неметалла, что приводит к образованию стабильных комплексов.
Комплексообразование имеет множество практических применений. Одним из наиболее известных примеров является водорастворимость солей. Комплексообразование позволяет образовывать водорастворимые комплексы металлов, что делает их доступными для использования в различных отраслях промышленности и техники.
Особенностью комплексообразования является возможность образования комплексов различной степени сложности. Например, между металлами и некоторыми неметаллами может образовываться одноатомный комплекс, содержащий одну молекулу неметалла. Однако также возможно образование комплексов с несколькими атомами неметалла, что в свою очередь увеличивает степень сложности комплекса.
Комплексообразование также может протекать при участии различных лигандов - веществ, которые образуют комплексы с металлами и неметаллами. Лиганды могут быть органическими или неорганическими соединениями и играют важную роль в процессе комплексообразования, определяя свойства и структуру полученных комплексов.
Электрохимический аспект

Взаимодействие металлов с неметаллами сопровождается процессом электрохимической реакции. При этом металлы могут быть либо активными, либо пассивными, в зависимости от их электрохимической активности.
Активные металлы характеризуются высокой реакционной способностью и платиновый металл, а также некоторые их сплавы, являются пассивными.
В процессе взаимодействия активных металлов с неметаллами происходит образование ионов металла и некоторые из них могут вступать в взаимодействие с неметаллами, образуя различные соединения и соединения. При этом электрохимическая активность металлов может приводить к передаче электронов от металла к неметаллу и последующей образованию ионов и катионов.
Электрохимический аспект взаимодействия металлов с неметаллами важен не только при изучении химических реакций, но и при понимании особенностей использования металлов в технике и промышленности. Знание электрохимических процессов позволяет предсказывать и контролировать их влияние на свойства и поведение материалов в различных условиях.
Коррозия металлов

Коррозия – это процесс разрушения металла под влиянием внешних факторов, таких как влага, кислоты или соли.
Одной из наиболее распространенных форм коррозии является электрохимическая коррозия, которая происходит при наличии электролита, включая влажное воздуховодородное соединение, и разделении металла на анод и катод. В результате анодный металл окисляется, а на катоде происходит восстановительный процесс.
Факторы, способствующие коррозии металлов, включают агрессивную среду, такую как кислотные или щелочные растворы, соли, окислители и другие поверхностно-активные вещества.
Существует несколько методов борьбы с коррозией, включая использование защитных покрытий, таких как краски и лаки, или специальных антикоррозионных составов. Также можно применять методы электрохимической защиты, например, катодную и анодную защиту, анодирование или гальваническое покрытие.
Гальванические элементы
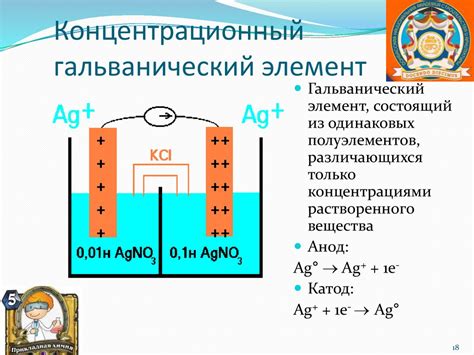
Гальванический элемент - это устройство, которое преобразует химическую энергию в электрическую. Принцип работы гальванического элемента основан на взаимодействии металла и неметалла, происходящем в электрохимической реакции.
Одним из основных элементов гальванического элемента является анод. Анод - это положительно заряженный электрод, на котором происходит окисление. В результате этого процесса, анод отдает электроны во внешнюю цепь.
Вторым элементом гальванического элемента является катод. Катод - это отрицательно заряженный электрод, на котором происходит восстановление. В результате этого процесса, катод принимает электроны из внешней цепи.
Между анодом и катодом происходит электрохимическая реакция. Избыток электронов на аноде и недостаток электронов на катоде создают разность потенциалов, что приводит к возникновению электрического тока.
Гальванические элементы имеют различные конструкции, включая одноразовые и многоразовые варианты. Они находят применение в различных сферах, включая энергетику, электронику, автомобильную промышленность и другие области.
Вопрос-ответ

Какие металлы считаются неметаллами?
В отличие от металлов, которые обладают характерными металлическими свойствами, неметаллы обладают иными физическими и химическими свойствами. В группу неметаллов входят, например, кислород, сера, хлор, фтор и многие другие элементы.
Как происходит взаимодействие металлов с неметаллами?
Взаимодействие металлов с неметаллами может происходить различными способами. Например, может произойти образование ионных связей, при которых металл отдает электроны неметаллу. Также может возникать ковалентная связь, при которой оба элемента делят электроны.
