Металлы являются важными компонентами нашей жизни. Они широко используются в различных отраслях науки и промышленности, а также в повседневной жизни. Однако, взаимодействие металлов с концентрированными кислотами может привести к различным химическим реакциям, которые не только опасны, но и имеют свои особенности и применение.
Концентрированные кислоты обладают высокой концентрацией и кислотностью, что делает их очень активными веществами. Когда металлы воздействуют на концентрированные кислоты, происходит их растворение или реакция с выделением газа. Это можно наблюдать, например, при взаимодействии цинка с соляной кислотой, где образуется хлорид цинка и выделяется водород.
Особенности взаимодействия металлов с концентрированными кислотами зависят от свойств самого металла, концентрации и кислотности кислоты, а также условий реакции, таких как температура и давление. Некоторые металлы, такие как алюминий, магний и цинк, способны реагировать с кислыми оксидами, образуя соответствующие соли. Другие металлы, например, железо и медь, могут образовывать с кислотами растворимые соли и газы, что может быть использовано в промышленности.
Взаимодействие металлов с концентрированными кислотами имеет свое применение в различных областях. Например, это может быть использовано для производства различных химических соединений, в технологических процессах металлургического производства, а также в процессах очистки воды и воздуха. Кроме того, это может быть использовано для удаления или нейтрализации отходов в промышленности, а также для получения различных продуктов, таких как газы или соли.
Взаимодействие металлов с концентрированными кислотами

Взаимодействие металлов с концентрированными кислотами – это процесс, при котором металлы реагируют с концентрированными кислотами, образуя соли и выделяя газы. Этот процесс является важным для различных областей науки и промышленности, так как позволяет получить соли металлов и использовать их в различных целях.
Реакция металлов с кислотами основана на образовании ионов металла и водорода. Некоторые металлы, такие как магний и цинк, реагируют с концентрированными кислотами очень активно, выделяя большое количество водорода и образуя соли. Другие металлы, например, железо и алюминий, реагируют медленнее, образуя менее растворимые соли.
Взаимодействие металлов с концентрированными кислотами имеет широкое применение в различных отраслях промышленности. Например, получение соли алюминия путем реакции алюминия с серной кислотой используется в производстве красителей, а также для получения алюминиевого оксида, который служит сырьем для производства керамики и стекла.
Кроме того, взаимодействие металлов с концентрированными кислотами может использоваться для очистки металлических поверхностей от оксидных пленок и загрязнений. Например, реакция цинка с серной или соляной кислотой позволяет удалить с поверхностей металла оксидные образования, что улучшает его свойства и повышает степень очистки.
Особенности химических реакций

Химические реакции между металлами и концентрированными кислотами происходят с сильным выделением энергии и могут протекать с высокой скоростью. Это связано с тем, что взаимодействие металлов с кислотами протекает по цепочке сложных химических реакций, включающих образование и разрушение химических связей.
Важное условие для проведения химической реакции между металлами и кислотами - наличие активного металла, способного образовывать ион в растворе. Чем больше активность металла, тем сильнее и быстрее протекает реакция. Концентрированные кислоты (например, серная, хлорная, азотная) обладают высокой активностью и способностью диссоциировать водные растворы.
В результате взаимодействия металлов с концентрированными кислотами возникают ионы металла и соответствующие соли. Однако, при этом также выделяются большие объемы газов (например, водород или хлор), что может привести к образованию пенных или взрывоопасных смесей. Поэтому такие реакции проводят с осторожностью и в специальных устройствах, чтобы избежать возможных опасностей.
Основной продукт реакции - соль металла с кислотой, которая образуется путем замещения водорода в кислоте металлом. Например, хлорид железа (FeCl2) или нитрат меди (Cu(NO3)2).
Реакции могут сопровождаться выделением тепла и света. Это связано с энергетическими изменениями, происходящими во время образования и разрушения химических связей.
Некоторые металлы могут образовывать цветные соединения при воздействии кислоты. Это связано с образованием комплексных соединений, в которых металл образует координационные связи с молекулами кислоты.
Температурные условия и кинетика взаимодействия
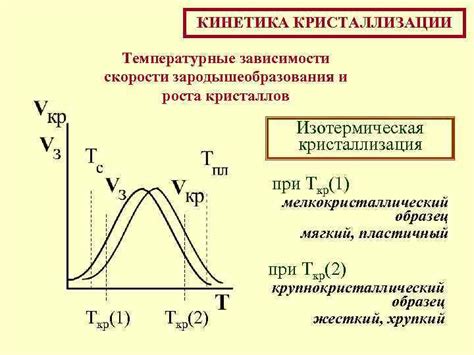
Взаимодействие металлов с концентрированными кислотами обычно происходит при повышенных температурах. Это связано с тем, что при высоких температурах активность атомов металла увеличивается, что способствует их более эффективной реакции с кислотами.
Кроме того, повышенная температура может ускорить процессы диффузии, что приводит к более интенсивному проникновению кислоты в структуру металла и, как следствие, более быстрому протеканию реакции.
Кинетика взаимодействия металлов с концентрированными кислотами может быть различной в зависимости от ряда факторов. Например, скорость реакции может зависеть от концентрации кислоты, температуры, присутствия катализаторов или ингибиторов.
Одним из важных факторов, влияющих на кинетику взаимодействия, является растворимость продуктов реакции. Если образующиеся в результате реакции продукты легко растворяются в кислоте, то скорость реакции будет выше, так как активные частицы металла могут быстро покидать поверхность и создавать условия для дальнейшей реакции.
Температурные условия и кинетика взаимодействия металлов с концентрированными кислотами являются важными аспектами при разработке процессов, связанных с получением и применением различных металлов и их соединений.
Практическое применение металлов в процессе реакции

Металлы играют важную роль в процессе взаимодействия с концентрированными кислотами в различных областях практической деятельности. Одним из самых распространенных применений металлов является их использование в процессе производства химических реакций. Например, металлы часто применяются в качестве катализаторов, ускоряющих химические реакции и повышающих их эффективность.
Многие металлы обладают способностью кислотности, то есть способностью образовывать кислотные растворы при взаимодействии с водой или другими растворителями. Это свойство металлов можно использовать для получения концентрированных кислотных растворов, которые находят свое применение в различных отраслях промышленности, включая производство удобрений, добывающую промышленность и производство электроэнергии.
Металлы также используются в процессе производства ионных средств для аккумуляторов. Металлы способны образовывать ионы, которые могут служить зарядами в аккумуляторах, обеспечивая их эффективную работу. Например, свинец используется в свинцово-кислотных аккумуляторах, а никель - в никель-кадмиевых или никель-металл-гидридных аккумуляторах.
В процессе производства металлов также активно применяются концентрированные кислоты. Например, серная кислота широко используется для очистки и обработки металлов, таких как железо и алюминий. Она может растворять нежелательные примеси и окислители, позволяя получить высококачественные металлы. Также серная кислота используется в процессе производства удобрений, текстильной промышленности и других отраслях.
Влияние концентрации кислоты на химическую реакцию

Концентрация кислоты является одним из важных факторов, влияющих на химическую реакцию между металлами и кислотами. При повышении концентрации кислоты происходит ускорение реакции, так как количество активных ионов кислоты увеличивается.
При взаимодействии металлов с концентрированными кислотами образуются соли и выделяется водород. Повышение концентрации кислоты способствует более интенсивному образованию солей, так как растворимость солей величается с увеличением концентрации ионов. Таким образом, рост концентрации кислоты увеличивает количество образующихся солей и количество выделяющегося водорода.
Высокая концентрация кислоты может также повысить скорость реакции металла с кислотой, так как большое количество ионов кислоты позволяет более быстро достичь точки насыщения металла и произвести химическое разрушение его поверхности. Кроме того, повышенная концентрация кислоты может спровоцировать образование дополнительных реакционных путей, что также приводит к ускорению реакции.
Кислоты: сильные и слабые
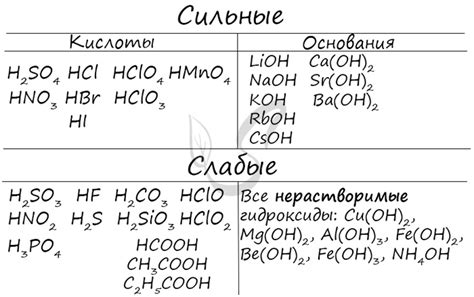
Кислоты — это важный класс химических соединений, обладающих кислотными свойствами. Кислоты могут быть сильными или слабыми в зависимости от их способности отдавать протоны (водородные ионы) в растворе.
Сильные кислоты полностью диссоциируются, то есть распадаются на ионы в водном растворе. Примерами сильных кислот являются соляная кислота (HCl), серная кислота (H2SO4) и азотная кислота (HNO3). Эти кислоты обладают высокой электрофильностью и способны реагировать с различными металлами, образуя соли.
Слабые кислоты не полностью диссоциируются, то есть только небольшая часть молекул кислоты отдает протоны. Примерами слабых кислот являются уксусная кислота (CH3COOH), угольная кислота (H2CO3) и фосфорная кислота (H3PO4). Поскольку слабые кислоты не диссоциируют полностью, реакции, в которых они участвуют с металлами, протекают медленнее и образуют менее стабильные соли.
Взаимодействие металлов с кислотами определяется их активностью и электрохимическими свойствами. Например, активные металлы, такие как натрий и калий, реагируют с водой и сильными кислотами, образуя гидроксиды и соответствующие соли. Реакции этих металлов с кислотами могут сопровождаться выделением водорода.
Кислоты играют важную роль в химии и применяются в различных областях, включая производство солей и протекание реакций, необходимых для синтеза различных соединений. Понимание особенностей взаимодействия металлов с концентрированными кислотами позволяет контролировать химические процессы и создавать новые материалы с определенными свойствами.
Механизмы реакции и продукты
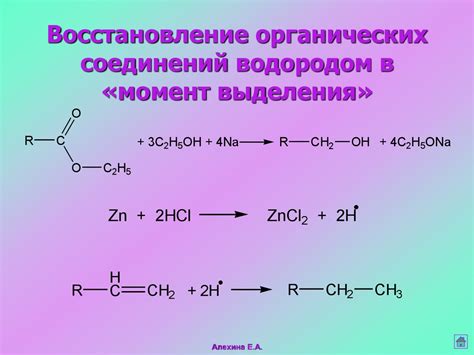
Взаимодействие металлов с концентрированными кислотами обусловлено особенностями химической структуры металла и кислоты. При контакте металла с кислотой происходит реакция, в результате которой образуются продукты.
Механизм реакции зависит от реактивности металла и кислоты. Реакция может протекать с образованием водорода, кислотного остатка или сочетания обоих продуктов. В случае реакции металла с кислотой, образующаяся соль растворяется в воде, а водород уходит в виде газа.
Продукты взаимодействия металлов с концентрированными кислотами могут быть различными в зависимости от вида металла и кислоты. Например, при реакции алюминия с концентрированной серной кислотой образуется сульфат алюминия и диоксид серы. При реакции железа с концентрированной соляной кислотой образуется хлорид железа и водород.
Металлы с разной степенью активности реагируют по-разному с кислотами. Например, реакция железа с соляной кислотой более интенсивна, чем реакция меди с этой же кислотой. Это связано с различной способностью металлов отдавать электроны и образовывать катионы.
Взаимодействие металлов с концентрированными кислотами имеет широкое применение в различных областях, включая химическую промышленность, электронику и металлургию. Например, реакция цинка с серной кислотой используется в бытовых химических источниках тока, таких как батарейки. Реакция алюминия с соляной кислотой применяется в процессе получения альфа-альюминия, который используется в производстве алюминиевых сплавов и композитных материалов.
Особенности безопасности и обращения с кислотами и металлами

Взаимодействие металлов с концентрированными кислотами является процессом, который требует особого внимания и соблюдения определенных мер безопасности. Кислоты обладают высокой степенью активности и могут вызывать серьезные ожоги на коже и слизистых оболочках. Поэтому необходимо работать с ними в специальных защитных средствах, таких как перчатки, защитные очки и халаты.
При обращении с металлами следует учитывать их реактивность по отношению к различным кислотам. Некоторые металлы, такие как железо или алюминий, могут активно реагировать с сильными кислотами, например, соляной или серной. При этом могут выделяться опасные газы, такие как сероводород или хлор. Поэтому для предотвращения реакции несовместимых веществ необходимо проводить эксперименты в специально оборудованных химических капсулах или глубоко под водой.
Помимо того, что необходимо соблюдать меры безопасности при работе с кислотами и металлами, также важно правильно хранить эти вещества. Кислоты должны храниться в специальных, хорошо закрытых емкостях, чтобы избежать проливания или выпаривания. Металлы следует хранить в сухих условиях, чтобы предотвратить их окисление и коррозию.
Важно также помнить о правилах обращения с отработавшими кислотами и металами. Они должны быть собраны и утилизированы в соответствии с экологическими требованиями. Для этого необходимо обратиться к специализированным службам или распорядиться ими самостоятельно с соблюдением всех правил и рекомендаций.
Вопрос-ответ

Какие металлы реагируют с концентрированными кислотами?
С концентрированными кислотами реагируют различные металлы, включая щелочные металлы (например, натрий и калий), щелочноземельные металлы (например, магний и кальций), а также более тяжелые металлы, такие как железо, цинк и свинец.
Какие реакции протекают при взаимодействии металлов с концентрированными кислотами?
При взаимодействии металла с концентрированной кислотой обычно происходит образование соли и выделение водорода. Например, реакция цинка с соляной кислотой выглядит следующим образом: Zn + 2HCl → ZnCl2 + H2. В некоторых случаях могут образовываться и другие продукты реакции, например, при взаимодействии железа с серной кислотой образуется сульфат железа и сернистый газ.
