Металлы, являясь основными элементами химических реакций, демонстрируют различные свойства при взаимодействии с различными кислотами. В случае взаимодействия металлов с концентрированной азотной кислотой (HNO3), происходят интенсивные и часто опасные реакции. Это вызвано химической активностью азотной кислоты и ее способностью окислять различные вещества.
Взаимодействие металлов с концентрированной азотной кислотой может привести к образованию различных продуктов. Некоторые металлы, такие как железо (Fe), медь (Cu) и олово (Sn), способны реагировать с азотной кислотой, образуя нитраты металлов и оксиды азота. Например, взаимодействие железа с азотной кислотой приводит к образованию нитрата железа (Fe(NO3)2) и оксида азота (NO).
Однако, не все металлы реагируют с азотной кислотой таким образом. Алюминий (Al), например, образует пассивную пленку оксида алюминия (Al2O3) на своей поверхности, что предотвращает последующее взаимодействие с кислотой. Таким образом, алюминий не растворяется в концентрированной азотной кислоте.
Взаимодействие металлов с концентрированной азотной кислотой имеет широкий спектр применений. Например, получение нитратов меди и железа в основном используется в производстве удобрений. Также, реакция металлов с азотной кислотой широко применяется в лабораторных условиях для получения различных соединений и исследования их свойств.
В целом, изучение взаимодействия металлов с концентрированной азотной кислотой важно для понимания химических реакций и получения новых соединений с желаемыми свойствами. Это также помогает в разработке и оптимизации промышленных процессов, где использование данных реакций может быть значимо в процессе производства различных продуктов.
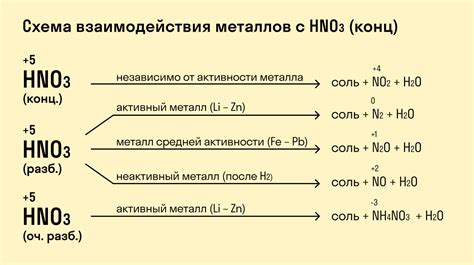
Реакция металлов с концентрированной азотной кислотой: общая информация

Реакция металлов с концентрированной азотной кислотой представляет собой одну из химических реакций, которые можно наблюдать в лаборатории или использовать для различных приложений в промышленности. Концентрированная азотная кислота, также известная как азотная кислота с высокой концентрацией, обладает сильной окислительной способностью.
При взаимодействии металлов с концентрированной азотной кислотой происходит реакция окисления металла. Азотная кислота действует как окислитель и отдает атомы кислорода в приполненный электроны металл, приобретая при этом восстановленное состояние. Результатом такой реакции может быть образование азотных оксидов, воды и азота в различных степенях окисления.
Концентрированная азотная кислота может реагировать с различными металлами, включая железо, медь, цинк и алюминий. В каждом конкретном случае происходит характерная реакция, которая определяется свойствами конкретного металла. Например, железо может образовывать нитриты, медь – нитраты, цинк – соли азотной кислоты, а алюминий – алюминаты.
Взаимодействие металлов с концентрированной азотной кислотой является не только интересным химическим процессом, но и имеет практическое значение. Например, такие реакции можно использовать в пиротехнике для создания эффектов искусственного огня. Кроме того, они находят применение в производстве различных химических соединений, включая нитраты и азотные кислоты.
Взаимодействие щелочных металлов с азотной кислотой
Щелочные металлы - это элементы первой группы периодической системы, включающие литий, натрий, калий, рубидий и цезий. Они характеризуются высокой реактивностью и активностью в химических реакциях. Взаимодействие этих металлов с азотной кислотой проявляется в нескольких реакциях, которые зависят от концентрации кислоты.
При взаимодействии щелочных металлов с разбавленной азотной кислотой (концентрация до 50%) происходит реакция образования нитратов металлов и выделения аммиака. Эта реакция является экзотермической и сопровождается выделением тепла.
Взаимодействие щелочных металлов с концентрированной азотной кислотой (концентрация более 70%) происходит гораздо более ярко и впечатляюще. Оно сопровождается интенсивным выделением аммиачного газа и высокой температурой. В результате образуется нитрат металла и соляная кислота.
Реакция щелочных металлов с азотной кислотой может быть представлена следующим образом:
- Металл + азотная кислота → нитрат металла + аммиак (разбавленная кислота).
- Металл + азотная кислота → нитрат металла + аммиачный газ + соляная кислота (концентрированная кислота).
Таким образом, взаимодействие щелочных металлов с азотной кислотой представляет собой химическую реакцию с образованием нитратов металлов и аммиака, сопровождающуюся выделением тепла и интенсивным газообразованием.
Амфотерность металлов в реакции с азотной кислотой
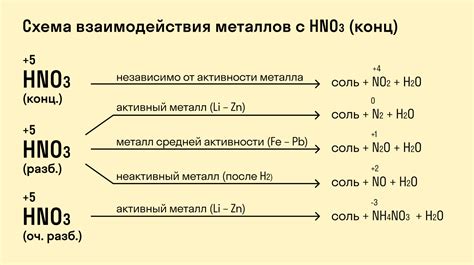
Металлы обладают способностью проявлять амфотерное поведение при взаимодействии с азотной кислотой. Данная кислота представляет собой сильную окислительную среду, и потому реакция с металлами может протекать с образованием различных соединений.
Некоторые металлы, такие как железо и алюминий, проявляют способность растворяться в азотной кислоте с образованием соответствующих солей. Например, железо образует соединение Fe(NO3)3, а алюминий - Al(NO3)3. Эти соли могут быть использованы в различных химических процессах и промышленных производствах.
У других металлов, например, цинка и меди, азотная кислота проявляет амфотерное поведение. При взаимодействии этих металлов с кислотой образуются ионы соединений Zn(NO3)2 и Cu(NO3)2, а также азот оксиды, такие как NO и NO2. Образование данных оксидов свидетельствует о том, что в реакции участвует не только окислительное свойство азотной кислоты, но и ее восстановительное свойство.
Таким образом, амфотерность металлов в реакции с азотной кислотой подтверждается образованием соответствующих солей и оксидов. Это свойство металлов может использоваться в различных технологических процессах и при производстве различных химических соединений.
Реакция неметаллических металлов с азотной кислотой

Азотная кислота является сильным окислителем и способна взаимодействовать с различными металлами. В процессе этой реакции образуются соответствующие нитраты. Однако, неметаллические металлы могут проявлять особые свойства при контакте с азотной кислотой.
Неметаллический металл сера, например, может реагировать с концентрированной азотной кислотой, образуя нитрат серы и оксид азота. В результате этой реакции образуется ядовитый желтый газ диоксид азота. Реакция проходит с выделением большого количества тепла и может сопровождаться взрывами.
Другим примером неметаллического металла, реагирующего с азотной кислотой, является фосфор. При контакте с азотной кислотой он образует азотнокислый фосфор, который в дальнейшем может окисляться до фосфорной кислоты. Эта реакция сопровождается выделением оксидов азота и может быть сильно взрывоопасной.
Реакция неметаллических металлов с азотной кислотой требует осторожного обращения и проведения в специальных условиях, так как может привести к возгоранию или взрыву. Поэтому при работе с такими веществами необходимо соблюдать все меры предосторожности и проводить эксперименты только в хорошо оборудованных лабораториях.
Образование солей при реакции металлов с азотной кислотой
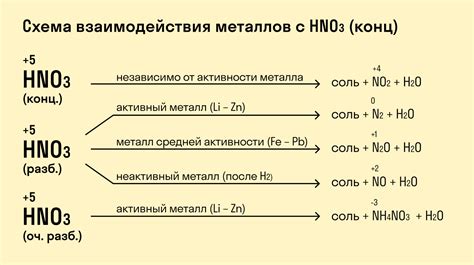
Реакция металлов с азотной кислотой является одной из наиболее известных и изучаемых химических реакций. В результате данной реакции образуются соли азотной кислоты, которые имеют широкое применение в различных отраслях промышленности и науки.
Образование солей происходит за счет окисления металла и одновременного образования аммония. В процессе реакции металл отдает электроны и образуется катион металла, который соединяется с анионом азотной кислоты, образуя соль.
Реакцию можно представить следующим образом: Металл + Азотная кислота → Соль + Вода + Азот. Например, реакция железа с азотной кислотой приводит к образованию соли, известной как нитрат железа. Реакция цинка с азотной кислотой ведет к образованию нитрата цинка.
Образование солей при реакции с азотной кислотой имеет большую практическую значимость. Например, нитраты металлов используются в производстве удобрений, пиротехнических смесей, взрывчатых веществ, а также в химическом анализе и исследованиях.
Таким образом, реакция металлов с азотной кислотой приводит к образованию солей, которые имеют широкое применение в различных областях промышленности и науки. Она основана на окислительно-восстановительных свойствах азотной кислоты и позволяет получить разнообразные соединения для дальнейшего использования.
Специфические реакции металлов с азотной кислотой
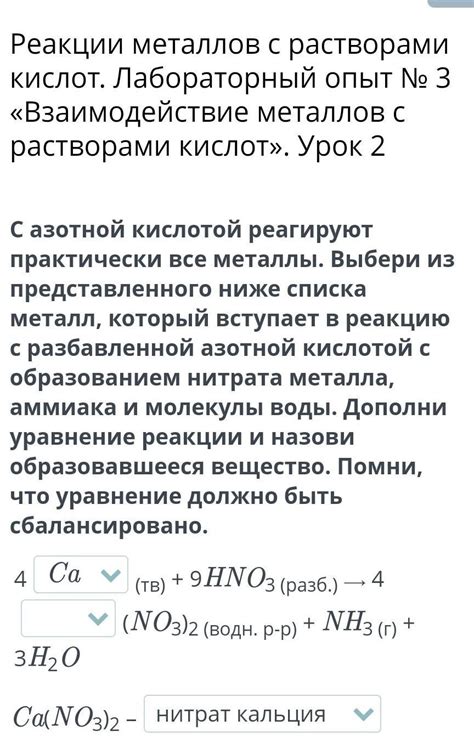
Азотная кислота, в своей концентрированной форме, является сильным окислителем и может проявлять реактивность взаимодействия с различными металлами. Такой процесс может протекать с выделением диоксида азота, а также образованием азотистых соединений.
Одна из специфических реакций металлов с азотной кислотой происходит с алюминием. При взаимодействии между ними происходит выделение диоксида азота и образование азотистого алюмината. Эта реакция может быть использована в химическом анализе для определения алюминия.
Второй пример – реакция цинка с азотной кислотой. В данном случае также происходит окисление цинка, выделение диоксида азота и образование азотата цинка. Эта реакция часто используется для получения азотнокислых солей цинка в лаборатории или в промышленности.
Окисление железа азотной кислотой приводит к образованию азотата железа, а также к выделению диоксида азота. Реакция между железом и азотной кислотой является важной в химическом анализе для определения наличия этого металла.
Также стоит отметить, что не все металлы проявляют реакцию с азотной кислотой. Например, золото, платина и свинец практически нереактивны к этому окислителю. Важно учитывать специфичность реакций металлов с азотной кислотой при их применении в различных областях науки и промышленности.
Примеры применения взаимодействия металлов с азотной кислотой
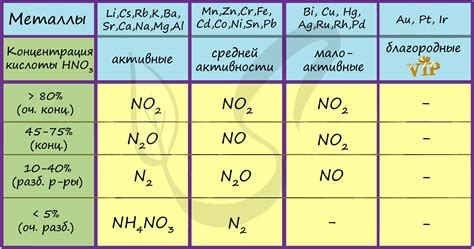
Взаимодействие металлов с концентрированной азотной кислотой имеет широкое применение в химической промышленности и лаборатории. Ниже приведены несколько примеров использования этой реакции:
- Производство нитратов. Взаимодействие металлов, таких как медь, свинец и железо, с азотной кислотой позволяет получать соответствующие нитраты. Например, реакция меди с азотной кислотой приводит к образованию медного нитрата, который широко используется в производстве взрывчатых веществ и удобрений.
- Получение азотных оксидов. Взаимодействие металлов с азотной кислотой может привести к образованию азотных оксидов, таких как азотистый оксид (NO) и диоксид азота (NO2). Эти вещества являются важными компонентами при производстве кислот и удобрений, а также служат основой для синтеза других соединений.
- Очистка и полировка металлов. Взаимодействие металлов с азотной кислотой может использоваться для очистки поверхностей от окислов и нагара, особенно в случае коррозии металлов. Также это взаимодействие может использоваться для полировки металлических изделий, придавая им блеск и гладкость.
- Синтез органических соединений. Взаимодействие металлов с азотной кислотой может быть использовано в органическом синтезе для получения различных аминов и нитро соединений. Например, реакция алканов с азотной кислотой может привести к получению аминов, которые используются в фармацевтической промышленности.
Таким образом, взаимодействие металлов с азотной кислотой является важным процессом в химической промышленности и широко используется для получения различных соединений и очистки поверхностей металлов.
Опасность при взаимодействии металлов с концентрированной азотной кислотой

Взаимодействие металлов с концентрированной азотной кислотой является опасным процессом, который может привести к серьезным последствиям.
Азотная кислота обладает высокой кислотностью и окислительными свойствами, что делает ее очень реактивным веществом. При контакте с металлами происходят интенсивные реакции, сопровождающиеся выделением ядовитых паров и образованием опасных продуктов.
В результате взаимодействия металлов с азотной кислотой может возникать пожар или взрыв. Процесс разрушения металлических образцов происходит с высокой скоростью, что может привести к резкому увеличению давления и распространению осколков.
Примером реакции металла с азотной кислотой является растворение меди. При взаимодействии меди с азотной кислотой образуется нитрат меди и выделяется диоксид азота, являющийся ядовитым газом.
Важно соблюдать осторожность при работе с концентрированной азотной кислотой и использовать специальные средства индивидуальной защиты, такие как защитные очки, перчатки и фартук. Также необходимо проводить работы в хорошо проветриваемых помещениях, чтобы избежать отравления ядовитыми газами.
Вывод: Взаимодействие металлов с концентрированной азотной кислотой является опасным процессом, требующим соблюдения мер предосторожности и использования специальных средств защиты. Нарушение правил безопасности может привести к серьезным последствиям для здоровья и безопасности работников.
Вопрос-ответ

Какие металлы взаимодействуют с концентрированной азотной кислотой?
С концентрированной азотной кислотой взаимодействуют многие металлы, такие как железо, цинк, медь, свинец, никель и другие. Это связано с тем, что азотная кислота обладает окислительными свойствами и способна реагировать с различными элементами.
Какие реакции происходят при взаимодействии металлов с концентрированной азотной кислотой?
При взаимодействии металлов с концентрированной азотной кислотой могут происходить различные реакции. Например, металлы могут окисляться, образуя соответствующие ионы металла и оксид азота. Также возможно образование аммиачной соли, если металлное изображение обмакнуть в концентрированную азотную кислоту. Некоторые металлы, такие как медь и свинец, растворяются в азотной кислоте, образуя соответствующие ионы металла в растворе.
Может ли взаимодействие металлов с концентрированной азотной кислотой привести к опасным последствиям?
Да, взаимодействие металлов с концентрированной азотной кислотой может привести к опасным последствиям. Например, при неправильном обращении с азотной кислотой возможно возникновение химических ожогов или отравления. Кроме того, при неконтролируемом взаимодействии металлов с азотной кислотой может произойти выделение токсичных газов, таких как оксиды азота, которые могут быть опасны для здоровья.
Какие металлы лучше не использовать в присутствии концентрированной азотной кислоты?
В присутствии концентрированной азотной кислоты лучше избегать использования реактивных металлов, таких как калий и натрий. Они могут вызывать сильные реакции, которые могут быть опасными. Также стоит избегать использования металлов, которые легко растворяются в азотной кислоте, таких как медь и свинец, если необходимо сохранить целостность и форму металлического образца.
