Взаимодействие металлов с концентрированной азотной кислотой является важной темой в химии и металлургии. При обычных условиях такое взаимодействие может протекать с различной интенсивностью и приводить к разным результатам. Изучение этого феномена позволяет более глубоко понять химические процессы, происходящие на поверхности металлов и в их окружении.
Особенности взаимодействия металлов с концентрированной азотной кислотой обусловлены химическими свойствами обоих компонентов. Азотная кислота (HNO3) является сильным окислителем, способным окислять многие металлы до ионов. Однако при взаимодействии некоторых металлов с азотной кислотой образуются пассивные пленки на их поверхности, что может привести к замедлению химической реакции или полному прекращению взаимодействия.
Ограничения взаимодействия металлов с концентрированной азотной кислотой также связаны с влиянием других факторов, таких как температура, концентрация кислоты и наличие примесей. Изменение этих параметров может существенно влиять на скорость реакции и ее результаты. Важно учитывать, что азотная кислота является ядовитым веществом, и все меры безопасности должны быть соблюдены при проведении экспериментов с ее использованием.
Условия эксперимента и выбор металлов

Для изучения взаимодействия металлов с концентрированной азотной кислотой при обычных условиях, был проведен ряд экспериментов. Основными условиями эксперимента было поддержание постоянной концентрации азотной кислоты, а также контроль температуры и времени воздействия.
Выбор металлов для эксперимента осуществлялся исходя из их реакционной активности и устойчивости при контакте с азотной кислотой. В экспериментах были использованы различные металлы, такие как железо, алюминий, цинк и медь. Это позволило изучить различные аспекты взаимодействия металлов с азотной кислотой и сравнить их поведение.
В процессе экспериментов было отмечено, что некоторые металлы, например, цинк и алюминий, реагируют с азотной кислотой с выделением газа и образованием соответствующих солей. Этот процесс сопровождается выделением тепла и может протекать довольно быстро. В то же время, другие металлы, такие как железо и медь, образуют растворимые нитраты без выделения газа.
Использование концентрированной азотной кислоты позволяет достичь более интенсивных реакций и получить более яркие результаты в экспериментах. Однако следует отметить, что данное взаимодействие имеет определенные ограничения и требует осторожного обращения с кислотой и металлами.
Воздействие азотной кислоты на металлы
Азотная кислота – это сильный окислитель, который может вызывать разрушительное воздействие на металлы при их взаимодействии. Это происходит из-за того, что азотная кислота содержит атомы азота, которые обладают высокой электроотрицательностью и могут стать активными агентами в химических реакциях.
Взаимодействие азотной кислоты с металлами может привести к различным результатам. Некоторые металлы, такие как алюминий и медь, могут реагировать с азотной кислотой, образуя соответствующие нитраты и оксиды. Эти реакции могут сопровождаться выделением газов и тепла.
Однако не все металлы имеют такую реакцию с азотной кислотой. Например, нержавеющая сталь обладает защитной пленкой оксида хрома, которая способна предотвратить дальнейшее реагирование металла с кислотой. Алюминий также образует защитную пленку оксида алюминия, которая может нейтрализовать дальнейшее воздействие азотной кислоты.
Ограничения взаимодействия металлов с азотной кислотой могут быть связаны с ее концентрацией и температурой. Высокая концентрация азотной кислоты и повышенная температура могут усилить коррозионные эффекты и вызвать быстрое разрушение металла.
Основные реакции между металлами и азотной кислотой
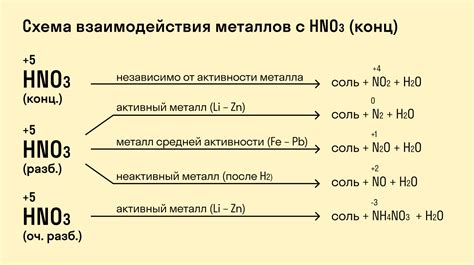
1. Образование азотистых оксидов
Одной из основных реакций между металлами и азотной кислотой является образование азотистых оксидов. Во время этой реакции, азотная кислота окисляет металл, образуя соединение, содержащее азотистые оксиды. Например, при взаимодействии железа и азотной кислоты, образуется азотистый оксид железа (III) Fe(NO2)3.
2. Выделение газа
Еще одной реакцией между металлами и азотной кислотой является выделение газа. Например, при взаимодействии алюминия и азотной кислоты, образуется алюминиевый нитрат Al(NO3)3 и выделяется оксид азота (II). Этот газ обладает специфическим запахом и может служить индикатором продуктов реакции.
3. Разрушение металла
В некоторых случаях, взаимодействие металлов с концентрированной азотной кислотой может привести к разрушению металла. Например, при растворении цинка в азотной кислоте, наблюдается интенсивная реакция, сопровождающаяся выделением большого количества газа и разрушением металла.
4. Образование комплексных соединений
Азотная кислота также может образовывать комплексные соединения с некоторыми металлами. Эти соединения обладают особыми свойствами и характеризуются сложной структурой. Например, азотистокислый ртуть (II) Hg2(NO2)2 образуется при взаимодействии ртути и азотной кислоты.
Образование нитратов и аминов

Металлы, взаимодействуя с концентрированной азотной кислотой, образуют нитраты и амины. Нитраты – это соединения, содержащие анион NO3-. В процессе взаимодействия металла с азотной кислотой, последняя окисляет металл, выделяя атомы кислорода. Металл реагирует с полученными атомами кислорода, образуя соединение с анионом NO3-.
Образование аминов связано с реакцией металла с нитратами, которые образуются в результате взаимодействия металла с азотной кислотой. При нагревании нитратов металлов сильными восстановителями, такими как формальдегид или аммиачная селитра, происходит образование аминов. Амины – это органические соединения, содержащие азот, связанный с углеродом (или несколькими углеродами).
Образование нитратов и аминов в результате взаимодействия металлов с концентрированной азотной кислотой при обычных условиях важно для химической промышленности и лабораторных исследований. Нитраты используются в производстве удобрений, пиротехнических составов и других химических соединений. Амины широко применяются в органическом синтезе, производстве лекарственных препаратов и красителей, а также в производстве пластмасс, резин и других материалов.
Влияние концентрации азотной кислоты на реакцию с металлами

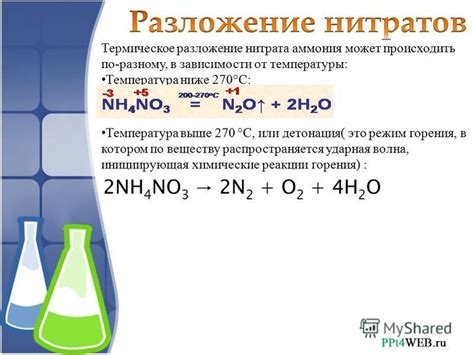
Взаимодействие металлов с концентрированной азотной кислотой является значительно более активным по сравнению с реакцией с разбавленной кислотой. При этом, концентрация азотной кислоты оказывает существенное влияние на скорость протекания реакции и ее окончательные продукты.
При низкой концентрации азотной кислоты металлический металл выделяется в виде нитевидных, волокнистых или порошкообразных отложений. Это объясняется слабой активностью азотной кислоты и отсутствием постоянного образования окислителя нитритного и нитратного ионов.
С увеличением концентрации азотной кислоты происходит увеличение скорости реакции и образования нитридов металлов. При этом, образуются различные типы нитридов: вакуольные, объемные или тонкомассные, в зависимости от степени насыщения и концентрации азотной кислоты.
Однако, при очень высокой концентрации азотной кислоты реакция может протекать слишком интенсивно, сопровождаясь выделением кислотных паров и различными опасными явлениями, такими как вспышка или взрыв. Поэтому, не рекомендуется проводить реакцию слишком концентрированной азотной кислотой без соответствующих мер предосторожности.
Факторы, влияющие на скорость реакции

Скорость реакции между металлами и концентрированной азотной кислотой зависит от нескольких факторов. Один из важных факторов - активность металла. Активные металлы, такие как натрий или калий, реагируют с азотной кислотой очень быстро, в то время как менее активные металлы, например, железо или цинк, могут реагировать медленнее.
Еще одним фактором является концентрация азотной кислоты. Более концентрированная кислота обеспечивает больше смещение равновесия в сторону продуктов реакции, что приводит к увеличению скорости реакции. Однако существуют определенные ограничения, так как слишком высокая концентрация кислоты может вызвать гидролиз металла, что замедлит реакцию.
Размер частиц металла также оказывает влияние на скорость реакции. Мелко измельченные металлические частицы имеют большую поверхность, что способствует более интенсивному взаимодействию с кислотой и, соответственно, увеличению скорости реакции.
Температура является еще одним фактором, влияющим на скорость реакции. Повышение температуры обычно увеличивает скорость реакции путем увеличения энергии частиц, что способствует более эффективному столкновению между металлом и кислотой. Однако очень высокая температура также может вызвать нежелательные побочные реакции или деструкцию металла. Таким образом, температура должна быть оптимальной для достижения максимальной скорости реакции.
Все эти факторы взаимодействуют между собой и должны быть учтены при исследовании скорости реакции между металлами и концентрированной азотной кислотой. Знание и контроль этих факторов позволяет более точно предсказывать и оптимизировать скорость реакции для различных практических применений.
Ограничения и опасности взаимодействия металлов с азотной кислотой

1. Коррозия металлов. Азотная кислота может вызывать коррозию многих металлов. При взаимодействии с кислотой образуются оксиды и нитраты, что приводит к разрушению металлической поверхности. Это может стать причиной повреждения и неработоспособности оборудования, содержащего металлические элементы.
2. Высокая реактивность. Азотная кислота является сильным окислителем и может реагировать с различными веществами, включая металлы. Это может привести к возникновению опасных химических реакций, выделению токсичных газов и дымов, а также возгоранию.
3. Ограниченный спектр совместимых металлов. Некоторые металлы могут быть несовместимы с азотной кислотой и подвергаться интенсивной коррозии даже при незначительном воздействии кислоты. Важно учитывать данное ограничение при выборе материала для хранения или транспортировки азотной кислоты, а также при проведении химических экспериментов.
4. Опасность для здоровья. Азотная кислота является ядовитым веществом и может быть опасной при вдыхании паров или попадании на кожу. При взаимодействии кислоты с металлами может образовываться азотистый оксид (дым азотной кислоты), который является высокотоксичным веществом. Работа с азотной кислотой требует соблюдения специальных мер предосторожности и использования средств индивидуальной защиты.
5. Взрывоопасность. Некоторые металлы, такие как медь, цинк и свинец, могут реагировать с азотной кислотой взрывоопасным образом при определенных условиях. При смешивании концентрированной азотной кислоты с некоторыми металлическими порошками или фрагментами металла может возникнуть реакция, сопровождающаяся высокой температурой и газообразными продуктами, в том числе взрывоопасными.
Все эти ограничения и опасности подчеркивают важность правильной и безопасной работы с азотной кислотой и требуют соблюдения специальных мер предосторожности и стандартов безопасности.
Вопрос-ответ

Какие металлы реагируют с концентрированной азотной кислотой?
Концентрированная азотная кислота реагирует с большинством металлов, включая железо, медь, цинк, магний и алюминий.
Что происходит при взаимодействии металлов с концентрированной азотной кислотой?
При взаимодействии металлов с концентрированной азотной кислотой образуется нитрат соответствующего металла и выделяется оксид азота или диоксид азота в виде газа.
Каковы особенности взаимодействия алюминия с концентрированной азотной кислотой?
Одной из особенностей взаимодействия алюминия с концентрированной азотной кислотой является способность алюминия образовывать защитную оксидную пленку на своей поверхности, которая может замедлить реакцию. Однако, при длительном взаимодействии азотной кислоты с алюминием, пленка может разрушиться, что приведет к более интенсивной реакции.
Могут ли металлы реагировать с концентрированной азотной кислотой при обычных условиях безопасно?
Обычно взаимодействие металлов с концентрированной азотной кислотой является опасным, так как сопровождается выделением токсичных и взрывоопасных газов. Поэтому следует проявлять особую осторожность при проведении подобных реакций.
Какие возможные ограничения существуют при взаимодействии металлов с концентрированной азотной кислотой?
Одним из ограничений является низкая степень реакции некоторых металлов с концентрированной азотной кислотой, например, углерода. Кроме того, некоторые металлы могут образовывать инертные оксидные пленки, что замедляет реакцию. Также следует отметить, что взаимодействие азотной кислоты с металлами может приводить к образованию токсичных продуктов, которые необходимо учитывать при проведении реакции.
