Реакция металлов с кислотами является одним из классических экспериментов в химии. При взаимодействии металла с кислотой происходит выделение газа. Почему это происходит и какие факторы влияют на скорость реакции?
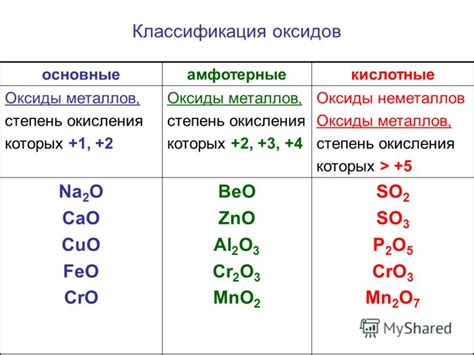
Основным фактором, определяющим выделение газа при реакции металлов с кислотами, является активность металла. В таблице активности металлов можно увидеть, что металлы расположены по возрастанию активности. Наиболее активные металлы, такие как литий, натрий и калий, реагируют очень быстро с кислотами и выделяют значительное количество газа. Менее активные металлы, такие как медь и серебро, реагируют медленнее и выделяют меньше газа.
Однако, активность металла это не единственный фактор, влияющий на скорость и интенсивность реакции с кислотами. Другим важным фактором является концентрация кислотного раствора. Чем выше концентрация кислоты, тем быстрее протекает реакция и больше выделяется газ. Также, реакция металла с кислотой может быть ускорена повышением температуры реакционной смеси.
Металлы - кислоты: почему граница газ?
Газообразное вещество образуется при реакции металлов с кислотами из-за образования водорода. Когда металлический элемент вступает в химическую реакцию с кислотой, происходит обмен ионами: ионы металла переходят в раствор, а ионы водорода образуются из диссоциированных ионов водородного катиона.
Реакция между металлом и кислотой идет с выделением энергии в виде тепла. В результате этой экзотермической реакции образуется тепловой заряд, который способствует образованию паров воды. Водород, выделяющийся во время реакции, является газообразным веществом и из-за своей низкой плотности поднимается к верхушке смеси.
К слову, не все металлы реагируют с кислотами и образуют газ. Активные металлы, такие как цинк, железо или алюминий, способны образовывать реактивный водород и вызывать достаточно сильную реакцию с кислотой. Однако другие металлы, например, медь или серебро, реагируют образованием слабого водорода, который образуется на поверхности металла и не образует газообразной смеси.
Вывод: газ возникает в результате образования водорода при реакции металла с кислотой и его подъема вверх из-за низкой плотности.
Физические свойства металлов и кислот
Металлы - это элементы химической системы, обладающие определенными физическими свойствами. Одной из таких свойств является высокая теплопроводность, что обусловлено наличием свободных электронов в кристаллической решетке металла. Это позволяет металлам быстро отводить тепло при взаимодействии с кислотами.
Кислоты - это химические соединения, обладающие рядом характерных физических свойств. Одним из таких свойств является их способность реагировать с металлами, образуя соли и выделяя газ. Реакция происходит в результате образования ионов водорода (Н+) при диссоциации кислоты.
Выделение газа при реакции металлов с кислотами обусловлено наличием взаимодействующих компонентов. Металлы, обладая низкой ионизационной энергией, отдают свои электроны кислоте. В результате образуются положительно заряженные ионы металла (M+) и отрицательно заряженные ионы кислоты (An-).
Газ, который выделяется при реакции, является водородом (H2). Водород образуется на катоде металла и является одним из элементарных газов, которые нейтральны и не имеют вкуса и запаха. Накопление образующегося газа приводит к его выделению в виде пузырьков.
Электрохимические свойства веществ

Электрохимические свойства веществ являются одним из важных аспектов изучения химии. Они связаны с переносом зарядов и протеканием электрохимических реакций.
Одним из основных понятий в электрохимии является электрод. Электроды представляют собой проводники, которые могут принимать участие в электрохимических реакциях. Они делятся на аноды и катоды. Анод - это электрод, на котором происходит окисление (потеря электронов), а катод - это электрод, на котором происходит восстановление (приобретение электронов).
Важным свойством веществ в электрохимии является их электродный потенциал. Электродный потенциал указывает на склонность вещества отдавать или принимать электроны в электрохимической реакции. Большинство таблиц электродных потенциалов строятся относительно стандартного водородного электрода (SHE), который имеет электродный потенциал равный нулю.
Электрохимические реакции могут протекать в различных средах: в растворах, расплавах, газовой фазе и др. При этом, важную роль играет ионная проводимость веществ. Ионная проводимость зависит от способности ионов двигаться в электрическом поле. Высокая ионная проводимость позволяет эффективно протекать электрохимическим реакциям и облегчает проведение электрического тока через вещество.
Связь между металлами и кислотами
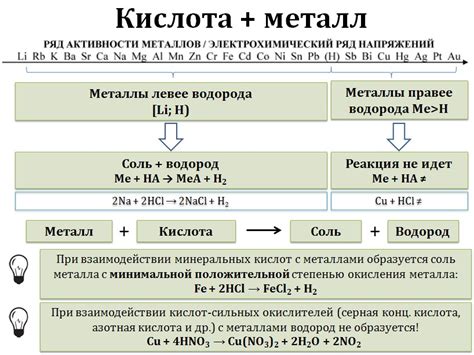
Связь между металлами и кислотами основана на химической реакции, которая происходит между ними. Когда металл вступает во взаимодействие с кислотой, происходит обмен ионами, что приводит к образованию соли и выделению газа.
В ходе реакции металл отдает электроны кислоте, образуя положительно заряженные ионы металла. В свою очередь, кислота отдаёт протоны (H+) металлу, образуя отрицательно заряженные ионы кислоты. Это обмен ионами называется окислительно-восстановительной реакцией.
Выделение газа в ходе реакции обусловлено образованием пузырьков газа, которые возникают в результате отделения молекул воды. Газ выпускается как результат присутствия воды в реагентах или образования в процессе реакции воды. Тип выделяющегося газа зависит от конкретных металлов и кислот, участвующих в реакции.
Например, при взаимодействии цинка с соляной кислотой образуется хлорид цинка и выделяется водородный газ:
- Цинк + соляная кислота → хлорид цинка + водородный газ
Аналогично, при реакции алюминия с серной кислотой образуется сульфат алюминия и выделяется сернистый газ:
- Алюминий + серная кислота → сульфат алюминия + сернистый газ
Таким образом, связь между металлами и кислотами проявляется в окислительно-восстановительной реакции, в результате которой образуется соль и выделяется газ. Это явление имеет широкое применение в химической промышленности и в лаборатории при проведении химических экспериментов.
Образование и свойства солей

Соли — это химические соединения, состоящие из положительно и отрицательно заряженных ионов, которые образуются в результате реакции между кислотами и основаниями. Образование солей происходит в реакции нейтрализации, когда кислота и основание взаимодействуют, образуя воду и соль.
Соли имеют определенные свойства, которые зависят от ионов, из которых они состоят. Одним из важных свойств солей является их способность растворяться в воде и образовывать растворы. Растворы солей могут быть кислыми, основными или нейтральными в зависимости от природы соли.
Соли также обладают кристаллической структурой, что делает их твердыми и хрупкими. Большинство солей имеют высокую температуру плавления и кипения. Кристаллические соли могут образовывать разнообразные формы, такие как кубы, призмы или таблетки, в зависимости от атомной структуры и ионных радиусов вещества.
Кроме того, соли могут обладать определенными цветовыми свойствами, что зависит от наличия примесей в кристалле. Некоторые соли могут быть окрашены в разные оттенки, такие как розовый, голубой или зеленый.
Виды химических реакций металлов с кислотами

Реакции металлов с кислотами являются одним из основных блоков химической теории и изучаются в рамках школьных уроков химии. В ходе этих реакций между металлом и кислотой происходит образование соли и выделение газа.
Выделяемый газ может быть различным в зависимости от типа кислоты и металла, принимающего участие в реакции. Самый часто встречающийся газ – это водород. Он образуется при взаимодействии большинства активных металлов с кислотами. Например, реакция цинка с соляной кислотой приводит к образованию хлорида цинка и выделению молекул водорода.
Также газами, которые могут образовываться при реакции металлов с кислотами, являются оксиды металлов и двуокись серы. Такие реакции, образующие оксиды, происходят, например, при соотношении цинк с азотной кислотой. А реакции, в результате которых выделяется двуокись серы, возникают при взаимодействии алюминия с серной кислотой.
Таким образом, реакции металлов с кислотами могут приводить к выделению различных газов, в зависимости от типа кислоты и металла. Понимание и изучение этих реакций помогает более глубоко понять основы химии и химические свойства веществ.
Объяснение выделения газа при реакции

Выделение газа при реакции металлов с кислотами объясняется химическим процессом, происходящим между данными веществами. В результате этой реакции образуется новое соединение, при этом освобождается газ.
Когда металл вступает в реакцию с кислотой, происходит обмен ионами между реагентами. Кислота отдает свои положительно заряженные водородные ионы (H+) металлу, который, в свою очередь, отдает свои отрицательно заряженные металлические ионы. Этот процесс сопровождается освобождением газа, в большинстве случаев это водород (H2).
Выделение газа при реакции зависит от активности металла и его реакционной способности. Некоторые металлы, такие как цинк (Zn) или алюминий (Al), активно взаимодействуют с кислотами и выделяют газ даже при небольшом количестве кислоты. Другие металлы, такие как медь (Cu) или железо (Fe), могут взаимодействовать с кислотой только при наличии большого количества кислоты или под действием нагревания.
Процесс выделения газа при реакции металлов с кислотами является одной из основных характеристик данных реакций. Он может быть использован для идентификации металлов и определения их активности. Также этот процесс имеет практическое применение, например, в водородных генераторах, где выделение водорода при реакции металла с кислотой используется для получения энергии.
Кальций и соляная кислота: подробный пример

Кальций – это химический элемент, относящийся к щелочноземельным металлам, который реагирует с различными кислотами. Одной из самых известных кислот, с которой кальций реагирует, является соляная кислота (HCl). Реакция кальция с соляной кислотой протекает в результате обмена, сопровождается выделением газа и проявляется в виде химичесной реакции.
Соль кислоты, как известно, образуется в результате реакции кислоты с щелочью, металлом или основанием. В случае реакции кальция с соляной кислотой образуется соль хлорида кальция (CaCl2) и выделяется газ водород (H2). Реакция может быть представлена следующим уравнением:
Ca + 2HCl → CaCl2 + H2
Газ водород выделяется в виде пузырьков в результате реакции кальция с соляной кислотой. Поскольку газ легче, чем жидкость, пузырьки всплывают и выделяются. Именно благодаря выделению газа в процессе реакции можно наблюдать явное проявление реакции, так как газ образует видимую физическую структуру.
Реакция кальция с соляной кислотой является химической реакцией, протекающей с выделением газа. Такие реакции имеют широкий спектр применений, их результаты могут использоваться в различных областях, включая производство, пищевую промышленность и другие области науки и технологий.
Выводы и практическое применение знаний

Изучение реакции металлов с кислотами позволяет сделать ряд важных выводов. Во-первых, при взаимодействии металлов с кислотами происходит выделение газа. Этот газ является результатом реакции между водородом, который содержится в кислоте, и металлом.
Во-вторых, реакция металлов с кислотами протекает с образованием соли и выделением водорода. Образование соли происходит благодаря обмену ионами между металлом и кислотой. Это является основой синтеза солей - важного процесса в химии.
Третий вывод - реакция металлов с кислотами является экзотермической, то есть сопровождается выделением тепла. Это можно наблюдать при проведении экспериментов, когда металлы реагируют с кислотами под действием нагревания.
Знание о реакции металлов с кислотами имеет практическое применение в различных областях. Например, в промышленности данный процесс используется для получения солей металлов, которые широко применяются в производстве красителей, удобрений, лекарств и других продуктов. Также, реакция металлов с кислотами может использоваться в химических лабораториях для получения нужных соединений и проведения анализов.
Вопрос-ответ

Какие металлы реагируют с кислотами?
С кислотами реагируют различные металлы, такие как цинк, железо, магний, алюминий и другие.
Почему при реакции металлов с кислотами выделяется газ?
При реакции металлов с кислотами выделяется газ из-за образования соли и водорода. Металл образует соль с кислотой, а молекулы водорода выделяются в виде газа.
Каков механизм реакции металлов с кислотами?
Механизм реакции металлов с кислотами включает в себя два основных этапа: сначала происходит окисление металла, при котором ионы металла теряют электроны и превращаются в положительно заряженные ионы. Затем происходит восстановление водорода, при котором молекулы воды получают электроны и превращаются в отрицательно заряженные ионы. В результате этих процессов образуется соль и выделяется водород в виде газа.
