Металлы и кислоты - два основных и важных компонента в химических реакциях. Они играют важную роль в различных областях науки и технологии, включая промышленность, медицину и сельское хозяйство. Взаимодействие металлов с кислотами является одной из ключевых тем изучения химии и предлагает практические применения.
Металлы реагируют с кислотами, образуя соли и выделяя водород. Реакция характеризуется образованием ионов металла, ионов водорода и анионов кислоты. Например, реакция железа с соляной кислотой может быть представлена следующим образом:
Fe + 2HCl -> FeCl2 + H2
Такие реакции часто используются в лаборатории и в промышленности для получения солей металлов, которые имеют широкое применение в различных областях. Например, применение железных солей в производстве красителей и лекарственных препаратов или использование алюминиевых солей в производстве металлических сплавов.
Роль металлов в химических реакциях с кислотами
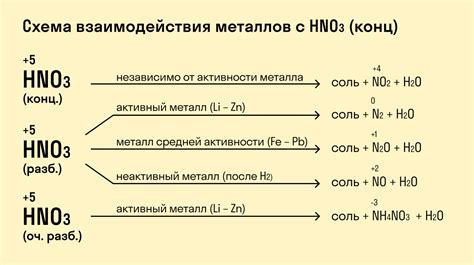
Металлы играют важную роль в химических реакциях с кислотами. Они могут реагировать с кислотами, образуя соли и выделяя водород. Это свойство металлов основано на их активности и способности отдавать электроны.
Металлы, находящиеся в таблице активности металлов выше водорода, реагируют с кислотами, освобождая молекулы водорода. Например, цинк реагирует с соляной кислотой по следующей реакции: Zn + 2HCl → ZnCl2 + H2. При этом образуется хлорид цинка и выделяется молекулы водорода, которые можно обнаружить по их способности гореть в воздухе.
Реакция металлов с кислотами особенно интересна для проведения различных практических опытов и демонстраций в химическом образовании. Например, можно провести опыт с использованием разных металлов и кислот, а затем сравнить их активность и скорость реакции. Такие опыты позволяют учащимся лучше понять химические свойства металлов и кислот, а также развить навыки наблюдения, анализа результатов и проведения экспериментов.
Важно отметить, что химические реакции металлов с кислотами могут быть опасными и требуют соблюдения техники безопасности. Необходимо работать в хорошо проветриваемом помещении, носить защитные очки и перчатки, а также соблюдать правила обращения с химическими веществами. Все эксперименты должны проводиться под наблюдением опытного преподавателя или специалиста.
Виды металлов в химических реакциях с кислотами
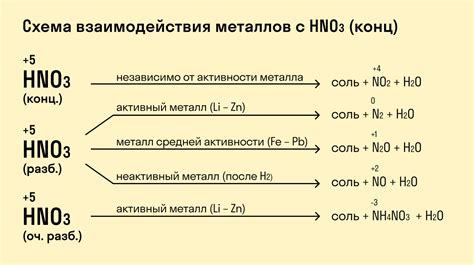
Металлы - это элементы, которые обладают хорошей проводимостью электричества и тепла, а также могут реагировать с кислотами. Взаимодействие металлов с кислотами может привести к различным химическим реакциям, в результате которых образуются соли и выделяется водород.
Существует несколько видов металлов, которые реагируют с кислотами по-разному. Одним из наиболее распространенных видов металлов являются щелочные металлы, такие как натрий, калий и литий. Они обладают высокой реакционной способностью и могут сильно реагировать с кислотами, особенно с кислотой соляной.
Второй вид металлов - это металлы-щелочноземельные, такие как магний, кальций и бериллий. Они обладают менее активной реакционной способностью по сравнению с щелочными металлами. Однако они все равно могут реагировать с различными видами кислот, например, с кислотой серной.
Еще одним видом металлов, которые могут реагировать с кислотами, являются переходные металлы, такие как железо, медь и цинк. Они обладают более слабой реакционной способностью по сравнению с щелочными металлами и металлами-щелочноземельными. Переходные металлы нередко реагируют с кислотами с выделением водорода и образованием соответствующих солей.
Таким образом, виды металлов в химических реакциях с кислотами могут быть различными, и каждый из них имеет определенные характеристики и способность к взаимодействию. Понимание этих видов металлов и их реакционной способности может быть полезно при проведении химических экспериментов и понимании принципов химии.
Процесс взаимодействия металлов с кислотами

Взаимодействие металлов с кислотами является одним из фундаментальных процессов в химии. В результате этого взаимодействия происходят разные химические реакции, которые могут быть использованы в различных практических целях.
Взаимодействие металлов с кислотами происходит через процесс окисления и восстановления. Кислоты, в свою очередь, обладают свойством давать водородные ионы. Когда металл контактирует с кислотой, происходит передача электронов, что приводит к окислению металла и восстановлению кислоты.
Реакции взаимодействия разных металлов с кислотами могут различаться по интенсивности и скорости. Некоторые металлы, такие как магний и цинк, реагируют с кислотами относительно быстро и интенсивно, выделяя при этом газы. Другие металлы, например, серебро и золото, сравнительно плохо взаимодействуют с кислотами.
Процесс взаимодействия металлов с кислотами имеет практическое применение во многих отраслях науки и техники. Например, данный процесс используется при получении водорода, который является важным промышленным сырьем. Кроме того, взаимодействие металлов с кислотами может быть использовано для очистки от загрязнений и защиты металлических поверхностей от коррозии.
Таким образом, процесс взаимодействия металлов с кислотами является фундаментальным и имеет широкое практическое значение в различных областях науки и техники.
Примеры практического применения взаимодействия металлов с кислотами

1. Получение солей металлов. Один из основных примеров практического применения взаимодействия металлов с кислотами - получение солей металлов. Кислоты реагируют с металлами, образуя соли. Эти соли широко используются в различных отраслях промышленности и научных исследованиях. Например, соли железа используются в производстве металлических конструкций, окраске и покрытии поверхностей, а соли цинка - в гальваническом покрытии, производстве косметики и лекарственных препаратов.
2. Регулирование pH-уровня. Взаимодействие металлов с кислотами может использоваться для регулирования pH-уровня. Например, добавление щелочей к кислотам позволяет увеличить pH и привести его к щелочной среде. Это может быть полезным, например, при обработке воды, чтобы установить оптимальные условия для роста растений или создать безопасную среду для животных.
3. Утилизация отходов. Кислоты часто используются для утилизации металлических отходов. Например, реакция металлов с кислородной кислотой (серной, азотной и др.) может привести к образованию соответствующих солей и освобождению водорода. Это реакционное уравнение можно использовать для получения газа из металлических отходов, что способствует их эффективной утилизации.
4. Производство электроэнергии. Взаимодействие металлов с кислотами также находит применение в производстве электроэнергии. Примером такого использования является гальванический элемент, в котором металл размещается в кислотном растворе. Эти элементы широко применяются в различных устройствах, таких как батарейки или аккумуляторы, которые обеспечивают источник энергии для многих электронных устройств.
5. Аналитическая химия. Взаимодействие металлов с кислотами играет важную роль в аналитической химии. Реакции металлов с кислотами могут использоваться для определения содержания определенных элементов или соединений в образцах. Например, растворение определенного металла в кислоте может использоваться для определения его концентрации в растворе. Это основа для многих методов анализа, которые используются в химическом анализе и качественном или количественном определении различных химических соединений.
Особенности взаимодействия некоторых металлов с кислотами

В химии существуют различные металлы, которые обладают разной степенью активности и реагируют с кислотами по-разному. Некоторые металлы проявляют большую химическую активность и способны быстро и интенсивно взаимодействовать с кислотами, в то время как другие металлы могут быть более инертными и медленно реагировать.
Металлы, такие как натрий, калий и литий, активно взаимодействуют с кислородными кислотами, такими как серная, хлороводородная и азотная кислоты. При контакте с такими кислотами эти металлы образуют соответствующие соли и выделяются водород. Реакция проходит с высокой интенсивностью и может сопровождаться выделением тепла и пламени.
Другие металлы, такие как железо и цинк, проявляют большую устойчивость к взаимодействию с кислотами. Железо, впрочем, может реагировать с сильными и концентрированными кислотами, но только при нагревании или в присутствии катализаторов. Цинк, например, пассивируется пленкой оксида на поверхности металла, что предотвращает его реакцию с кислотами.
Еще одной особенностью взаимодействия некоторых металлов с кислотами является выделение водорода. Например, алюминий, магний и цинк взаимодействуют с кислородными кислотами, образуя соответствующие соли и выделяя водород. Это явление может использоваться при проведении экспериментов и определении активности металлов.
Таким образом, взаимодействие металлов с кислотами зависит от химической активности металла, концентрации и силы кислоты, а также отличается реакционной способностью каждого металла. Изучение этих особенностей позволяет лучше понять процессы, происходящие при химических реакциях и сделать выводы о свойствах металлов.
Вопрос-ответ

Какие металлы были исследованы в эксперименте?
В эксперименте были исследованы алюминий, железо и медь.
Какие кислоты использовались в эксперименте?
В эксперименте использовались соляная кислота, уксусная кислота и серная кислота.
Какие результаты показал эксперимент?
Эксперимент показал, что алюминий реагирует с соляной кислотой, образуя соли и выделяя водород. Железо реагирует только с серной кислотой, а медь не реагирует ни с одной из кислот.
Какие применения может иметь полученная информация?
Полученная информация о взаимодействии металлов с кислотами может быть полезной при выборе материалов для различных химических процессов и изготовления оборудования, а также при проведении химических экспериментов в школьной лаборатории.
Какие выводы можно сделать на основании проведенного эксперимента?
На основании проведенного эксперимента можно сделать вывод, что различные металлы реагируют с кислотами по-разному, и реакционная способность металлов зависит от их электрохимического потенциала и химической активности.
