Окислительно-восстановительные реакции являются одними из основных реакций в неорганической химии. При таких реакциях происходит передача электронов между реагентами, что приводит к изменению степени окисления элементов. В одной из типичных комбинаций реагентов металлы выступают в роли восстановителей, а кислоты - в роли окислителей.
Некоторые металлы обладают высокой активностью и способны реагировать с кислотами, вытесняя из них водород. Например, реакция меди с соляной кислотой даёт солянокислую соль меди и водородный газ:
Cu + 2HCl -> CuCl2 + H2
Кислоты, в свою очередь, способны окислять металлы, вынуждая их отдавать электроны. Например, серная кислота может окислить железо, образуя сульфат железа:
2H2SO4 + Fe -> FeSO4 + 2H2O + SO2
Таким образом, взаимодействие металлов и кислот окислителей может привести к образованию солей, кислых остатков и водорода. Эти процессы находят широкое применение в различных областях химии и промышленности.
Металлы и кислоты: примеры окислительных реакций
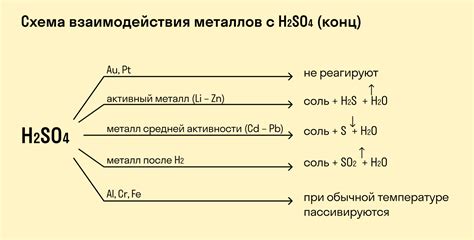
Металлы и кислоты могут взаимодействовать в окислительных реакциях, при которых металлы окисляются, а кислоты восстанавливаются. Такие реакции основаны на передаче электронов между частицами металла и ионами кислоты.
Примером окислительной реакции является взаимодействие железа с соляной кислотой. При этом образуется соль и выделяется водород. Уравнение реакции выглядит следующим образом:
Fe + 2HCl → FeCl2 + H2
Аналогичные реакции можно наблюдать при взаимодействии других металлов с кислотами. Например, цинк реагирует с серной кислотой, образуя сульфат цинка и выделяя газ.
Zn + H2SO4 → ZnSO4 + H2
Окислительные реакции металлов с кислотами широко используются в промышленных процессах, например при производстве сульфата меди или водорода. Они также играют важную роль в химических лабораториях и в повседневной жизни.
Важно отметить, что окислительные реакции металлов с кислотами могут быть опасными. Некоторые металлы, такие как натрий или калий, могут реагировать с кислотами очень быстро, сопровождаясь выделением большого количества газа и тепла. Поэтому при работе с кислотами и металлами необходимо соблюдать меры предосторожности и использовать соответствующую защитную экипировку.
Взаимодействие металлов с кислородом

Металлы могут вступать в реакцию с кислородом, которая называется окислением. В результате окисления металлы образуют оксиды, которые могут иметь различные свойства.
Окисление металлов с кислородом является одной из наиболее распространенных реакций в химии. Примером такой реакции является окисление железа воздухом под воздействием кислорода и влаги, что в результате приводит к образованию ржавчины.
Окислительно-восстановительные реакции, связанные с взаимодействием металлов с кислородом, имеют большое практическое значение. Например, для защиты металлов от окисления и коррозии применяются различные методы, включая покрытие металла слоем другого металла, образующего устойчивый оксид на поверхности.
Кроме того, окисление металлов с кислородом может протекать в батареях и аккумуляторах, где металлы служат в качестве электродов. В результате окисления происходит выделение электроэнергии, которая может быть использована в различных устройствах и системах.
Таким образом, взаимодействие металлов с кислородом является важным процессом, который имеет широкое применение в различных областях науки и техники.
Кислотное взаимодействие алюминия
Алюминий является активным металлом и обладает высокой реакционной способностью с кислотами. При контакте с кислотой, алюминий образует соль и выделяет молекулы водорода. Такое взаимодействие можно использовать в различных процессах.
Например, при контакте алюминия с соляной кислотой (HCl), происходит следующая реакция: Al + 2HCl = AlCl3 + H2. В результате образуется хлорид алюминия и выделяется молекулы водорода. Подобным образом алюминий реагирует и с другими кислотами, такими как серная кислота (H2SO4) или азотная кислота (HNO3).
Для того чтобы ускорить реакцию алюминия с кислотой, можно применить различные факторы, например, увеличить поверхность алюминиевого материала или повысить концентрацию кислоты. Важно знать, что при данном взаимодействии образуется соль, поэтому необходимо контролировать ее последующую обработку и утилизацию.
Кислотное взаимодействие алюминия находит применение в различных отраслях промышленности. Например, алюминий используется в качестве материала для производства батарей. При этом, кислотное окисление на поверхности алюминия позволяет получить электрическую энергию, необходимую для работы батареи. Также, алюминий широко применяется в аэрокосмической и авиационной отраслях, благодаря своей легкости и прочности при высоких температурах.
Окислительные свойства серной кислоты

Серная кислота, или кислота серы VI, является одним из самых сильных окислителей. Она способна окислять многие вещества, включая металлы. Окислительные свойства серной кислоты обусловлены ее способностью передавать кислородные атомы другим веществам.
Серная кислота может окислять металлы, образуя с ними соответствующие соли. Например, при взаимодействии серной кислоты с железом образуется соль - сульфат железа(II) или сернокислый железа(II).
Кроме того, серная кислота может окислять неметаллические элементы, такие как сероводород. В результате взаимодействия серной кислоты с сероводородом образуется сульфат, а сероводород окисляется до серы.
Окислительные свойства серной кислоты можно проиллюстрировать следующим примером:
- Серная кислота взаимодействует с медью, образуя сульфат меди(II) и выделяя газы: оксид серы VI и диоксид серы.
- Серная кислота вступает в реакцию с цинком, образуя сульфат цинка и выделяя водород.
Таким образом, окислительные свойства серной кислоты делают ее незаменимым веществом в химической промышленности и лабораторных условиях.
Медь и соляная кислота: химическая реакция и применение

Медь является одним из наиболее широко используемых металлов в различных областях промышленности и научных исследований. Ее высокая электропроводимость и химическая устойчивость делают ее незаменимым материалом для изготовления электрических проводов, медных труб, разных видов кабелей и многих других приборов и устройств.
С другой стороны, соляная кислота является одной из самых распространенных и важных кислот в химической промышленности. Она широко используется в процессе производства пластмасс, удобрений, химических реактивов и других продуктов.
Взаимодействие меди и соляной кислоты приводит к химической реакции, в результате которой образуется хлорид меди и выделяется кислород. Реакция происходит по следующему уравнению:
2Cu + 4HCl → 2CuCl2 + 2H2O + O2
В данной реакции медь окисляется под действием соляной кислоты, а соляная кислота восстанавливается. При этом образуется водород, который образует пузырьки. Количество выделенного кислорода можно определить по количеству образовавшихся пузырьков.
Интересно отметить, что хлорид меди полученный в результате реакции меди и соляной кислоты часто применяется в химической и электронной промышленности. Он используется в процессе производства красок, пигментов, пластмасс, электродов и других продуктов. Кислород, выделяющийся в результате реакции, также имеет важное применение, например, в металлургии или в процессе сжигания топлива.
Вопрос-ответ

Какие металлы могут быть использованы в качестве окислителей?
Металлы, которые имеют положительный потенциал окисления, могут быть использованы в качестве окислителей. Некоторые примеры таких металлов: железо, цинк, алюминий и медь.
Как происходит взаимодействие металлов с кислотами в качестве окислителей?
Когда металл взаимодействует с кислотой в качестве окислителя, он отдает электроны кислороду в кислоте, что приводит к образованию ионов металла. В результате такого взаимодействия происходит окисление металла и восстановление кислоты.
