Взаимодействие металлов с кислотами является одной из важных тем в химии. Под воздействием кислот, металлы способны образовывать различные соединения, которые могут быть как полезными, так и вредными. Каждое взаимодействие металла с кислотой сопровождается растворением металла и образованием продукта реакции.
Образующиеся вещества при взаимодействии металлов с кислотами могут быть солями, газами или другими соединениями. Результат реакции зависит от свойств металла и кислоты, а также от условий, в которых происходит реакция. Например, металл может образовывать растворимую соль, нерастворимый осадок или газ. Некоторые металлы могут обладать амфотерными свойствами и взаимодействовать как с кислотами, так и с основаниями.
Важно отметить, что взаимодействие металлов с кислотами может протекать с разной интенсивностью. Некоторые металлы, такие как железо или цинк, быстро реагируют с кислотами и образуют соли и водород. Другие металлы, например, серебро или золото, менее активны и образуют слабые реакции. Эти различия в активности металлов связаны с их положением в ряду напряжений электродов и способностью отдавать электроны при реакции с кислотами.
Металлы и кислоты: химические реакции и образующиеся вещества
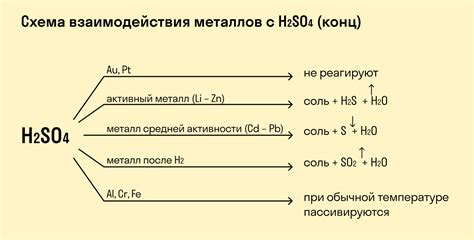
Металлы могут взаимодействовать с кислотами, образуя различные химические реакции и новые вещества. В таких реакциях происходит обмен элементами: металл замещает водород в кислоте, образуя соль и выделяяся молекулы воды.
В результате реакции металлов с кислотами образуются соли. Соли представляют собой химические соединения, которые образуются в результате обмена ионами между металлом и кислотой. Например, при взаимодействии цинка и соляной кислоты образуется хлорид цинка (ZnCl2), а при реакции меди с серной кислотой образуется сульфат меди (CuSO4).
Образующиеся вещества в реакции металлов с кислотами имеют свои химические и физические свойства. Например, соли, образующиеся при взаимодействии металлов с кислотами, обладают характерными кристаллическими структурами и растворяются в воде. Также, в реакциях могут образовываться газы, такие как водород или диоксид серы, которые выделяются в виде пузырьков при взаимодействии металла с кислотой.
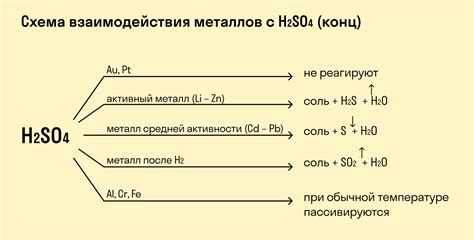
Однако, не все металлы взаимодействуют с кислотами. Некоторые металлы, такие как золото и платина, являются крайне устойчивыми к воздействию кислот и не реагируют с ними. Также стоит отметить, что не все кислоты взаимодействуют с металлами - для реакции чаще всего необходимо наличие водорода в кислоте или другой активной группы атомов.
Реакция металлов с кислотами: основные принципы и химические процессы
Реакция металлов с кислотами является одной из основных тем в химии и имеет огромное практическое значение. При этой реакции металлы образуют соли и выделяются водород. Основной принцип реакции заключается в том, что активные металлы, такие как натрий, калий, магний и алюминий, реагируют с кислотами, образуя соли и высвобождая водородный газ.
Кислоты, действующие на металлы, представляют собой водные растворы различных соединений с водородной кислотностью. Природа кислоты определяет общие свойства реакции, такие как скорость, интенсивность газообразования и тепловой эффект.
При реакции металлов с кислотами образуется соль и выделяется водород. Образовавшийся водородный газ можно обнаружить при помощи горения – он образует характерное пламя. Реакция также может сопровождаться выделением тепла и изменением цвета реагентов.
В зависимости от активности металла и концентрации кислоты, скорость реакции может значительно варьироваться. Некоторые металлы, такие как золото или платина, не реагируют с кислотами в обычных условиях, но сильно активные металлы, такие как калий и натрий, реакцию начинают уже при взаимодействии с влажным воздухом.
Категории металлов, взаимодействующих с кислотами, и их влияние на реакцию
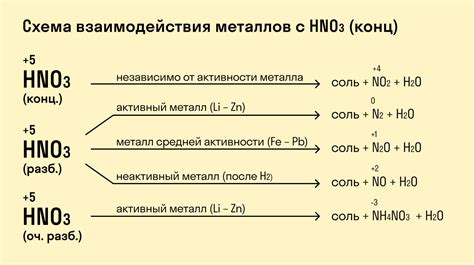
Металлы могут взаимодействовать с различными кислотами и образовывать разнообразные вещества в результате реакции. В зависимости от химических свойств металлов, можно выделить две основные категории, которые имеют различное влияние на процесс взаимодействия.
Первая категория включает активные металлы, такие как натрий, калий и магний. Эти металлы способны взаимодействовать с кислотами быстро и агрессивно. В результате таких реакций образуются соли и водород. Например, при взаимодействии натрия с соляной кислотой образуется натриевая соль и выделяется водородный газ. Эти металлы обладают высокой реакционной способностью и могут быстро растворяться в кислотах.
Вторая категория включает менее активные металлы, например, железо, цинк и алюминий. Эти металлы образуют более слабые реакции с кислотами, в результате которых образуются соответствующие соли и выделяется молекулярный водород. Например, железо при взаимодействии с соляной кислотой образует хлорид железа и выделяется водород. В отличие от активных металлов, эти металлы обладают более умеренной реакционной способностью и могут растворяться в кислотах несколько медленнее.
Таким образом, категория металлов, взаимодействующих с кислотами, и их реакционная способность имеют важное значение при изучении этой химической реакции. Знание таких особенностей позволяет предсказывать характер и скорость реакции и применять эти знания в реальной практике.
Получение солей в результате взаимодействия металлов с кислотами

При взаимодействии металлов с кислотами происходит образование солей. В данном процессе ионы металла заменяют ионы водорода в кислоте, образуя соль и выделяя молекулы воды.
Получение солей может происходить как путем прямого взаимодействия металла с кислотой, так и через промежуточные реакции с образованием химических соединений. Например, металлический алюминий может реагировать с соляной кислотой, образуя хлорид алюминия и выделяя молекулы воды.
Во время реакции с кислотами металлы проявляют активность, которая определяется их электрохимическими свойствами. Некоторые металлы, такие как натрий или калий, реагируют с кислотами сильно и быстро, выделяя большое количество водорода и образуя соли.
В результате взаимодействия металлов с кислотами образуются различные соли, которые могут иметь разные свойства и применения. Соли могут быть как растворимыми в воде, так и нерастворимыми. Это зависит от ионного состава соли и взаимодействия ее ионов с молекулами воды.
Таким образом, взаимодействие металлов с кислотами играет важную роль в химических реакциях и позволяет получить различные соли, которые широко применяются как в лаборатории, так и в промышленности.
Образование водорода и его роль в реакции металлов с кислотами
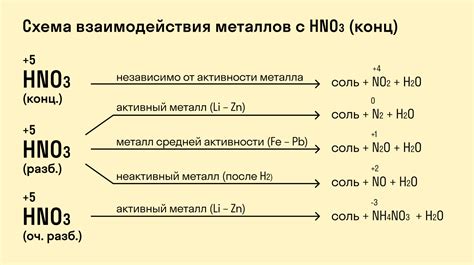
Взаимодействие металлов с кислотами является важным процессом в химии. В результате такой реакции образуется водородный газ и соответствующая соль. Образование водорода играет ключевую роль в этой реакции.
Водород является одним из самых распространенных элементов в природе и его присутствие в реакциях металлов с кислотами является неизбежным. Водород образуется в результате получения электронов из искрашенных металлов и протонов от протон-носителей, таких как кислоты.
Роль водорода в данной реакции заключается в том, что он обеспечивает электронный баланс. Водород принимает электроны от металла, приобретая положительный заряд, в то время как протон переходит от кислоты к металлу, приобретая отрицательный заряд. Это приводит к образованию водородного иона и соответствующей соли.
Избыточный водород, который не реагирует с металлами, выделяется в виде газа. Водород является легким и горючим элементом, поэтому его образование в реакции металлов с кислотами может сопровождаться выделением пузырей газа и его горением с характерной пламенем. Данное явление можно наблюдать, когда, например, медный монеты опускают в кислоту.
Таким образом, образование водорода является неотъемлемой частью реакции металлов с кислотами. Водородный газ, возникающий при этой реакции, имеет свою роль в химическом процессе, обеспечивая электронный баланс и приводя к образованию соли.
Практическое применение реакции металлов с кислотами: примеры и применение в промышленности
Реакция металлов с кислотами найдет свое практическое применение в различных областях промышленности. Например, в производстве цинка часто используется реакция цинка с серной кислотой. Эта реакция позволяет получить чистый цинк, который затем может быть использован для производства различных изделий.
Еще одним примером является реакция алюминия с соляной кислотой. В результате данной реакции образуется соль алюминия, которая широко применяется в промышленности, например, для производства красителей и алюминиевого порошка.
Реакция железа с соляной кислотой также имеет большое практическое значение. При реакции железа с соляной кислотой выделяется водород, который может быть использован для производства аммиака, в формировании легкорастворимых солей и во многих других процессах.
Практическое применение реакции металлов с кислотами также может наблюдаться в области защиты металлических конструкций от коррозии. Например, при реакции железа с соляной кислотой образуется соль железа, которая имеет защитное действие и может быть использована для покрытия металлических поверхностей и предотвращения их коррозии.
Таким образом, реакция металлов с кислотами имеет широкое практическое применение в промышленности. Она используется для получения чистых металлов, производства солей, получения водорода и защиты металлических конструкций от коррозии.
Вопрос-ответ

Какие вещества образуются при взаимодействии металлов с кислотами?
При взаимодействии металлов с кислотами образуются соли и выделяется водород.
Почему при взаимодействии металлов с кислотами образуются соли и выделяется водород?
Это связано с тем, что металлы обладают способностью активно вступать в реакцию с кислотами. При этом металлы отдают электроны кислоте, образуя положительно заряженные ионы металла, а водородные ионы, которые далее образуют молекулы водорода. Таким образом, образуются соли и выделяется водород.
Какие факторы влияют на скорость взаимодействия металлов с кислотами?
Скорость взаимодействия металлов с кислотами зависит от различных факторов, включая тип кислоты и металла, их концентрацию, температуру и поверхность контакта. Например, активность металла может быть больше или меньше в зависимости от его положения в ряду активности. Концентрация кислоты также может влиять на скорость реакции, а повышение температуры обычно увеличивает скорость химических реакций.
