Металлы - это химические элементы, обладающие свойствами твердого тела, блеском, хорошей теплопроводностью и электропроводностью. Одной из важнейших характеристик металлов является их способность взаимодействовать с кислотами и неметаллами.
Взаимодействие металлов с кислотами происходит посредством окислительно-восстановительных реакций, при которых металл отдает электроны и образует соответствующие ионы, а кислота принимает эти электроны и образует ионы водорода. При этом образуются соли металлов и вода. В зависимости от активности металла и кислоты, такие реакции могут быть мягкими и неполными или же сильными и полными.
Взаимодействие металлов с неметаллами, например, с кислородом, происходит при горении, что и является одной из основных причин коррозии металлов. Горение металла в кислороде сопровождается выделением тепла, пламенем и образованием оксидов. При этом металл окисляется, отдавая электроны, а кислород восстанавливается, получая электроны от металла. Результатом такой реакции является образование оксидов металлов, которые, в свою очередь, могут дальше реагировать с другими веществами.
Реакция металлов с кислотами: основные свойства и закономерности
Металлы и кислоты - это два основных класса веществ, взаимодействие которых может протекать с образованием соли и выделением водорода. Такие реакции широко изучены и найти применение как в научных исследованиях, так и в быту.
Общая закономерность реакций металлов с кислотами заключается в том, что металл отдает электроны кислоте, образуя положительные ионы, или катионы, в то время как водородные ионы с кислоты присоединяются к металлу, образуя молекулярный водород.
Во время взаимодействия металлов с кислотами наблюдается выделение газа - водорода, которое можно зафиксировать и использовать в различных процессах. Выделяющийся газ способен возгоняться, образуя плавающий пузырь и характерный звук, что является дополнительной способностью этой реакции.
Свойства реакции металлов с кислотами зависят от ряда факторов: массы металла, концентрации кислоты, температуры взаимодействия. Некоторые металлы реагируют сильнее, другие слабее, при этом важно учитывать их электрохимические свойства.
Реакция металлов с кислотами может протекать под влиянием катализаторов. Например, реакция алюминия с серной кислотой требует наличия катализатора – хлорангидрида железа. Катализатор повышает скорость реакции и способствует выделению большего количества водорода.
Положение металла в ряду активности также влияет на свойства реакции с кислотами. Металлы, находящиеся в верхней части ряда, реагируют с кислотами более интенсивно и легко, образуя соль и выделяя водород. Металлы, находящиеся в нижней части ряда, реагируют слабее и могут даже не реагировать с ограниченным спектром кислот.
Примеры реакций металлов с кислотами: реакция цинка с серной кислотой, реакция железа с соляной кислотой, реакция меди с азотной кислотой. Каждая реакция имеет свои особенности и закономерности, которые изучены и использованы в химической промышленности и научных исследованиях.
Классы металлов и типы их реакций с кислотами

Металлы могут быть разделены на несколько классов в зависимости от их активности и способности взаимодействовать с кислотами. Реакция металла с кислотой может привести к выделению водорода (H2), образованию солей или проявлению окислительных свойств.
Наиболее реакционные металлы, такие как натрий (Na) и калий (K), реагируют сильно с кислотами и образуют соль и высвобождаются большие количества водорода. Эти реакции обычно сопровождаются выделением тепла и пением.
Некоторые металлы, такие как железо (Fe) и цинк (Zn), проявляют среднюю активность в реакциях с кислотами. Они образуют соли и выделяют небольшое количество водорода. Более активные металлы могут вытеснить менее активные металлы из их солей, поэтому реакция металлов с кислотами может зависеть от их относительной активности.
Некоторые металлы, такие как медь (Cu) и серебро (Ag), обычно не реагируют с обычными кислотами, такими как соляная кислота (HCl) или серная кислота (H2SO4). Однако, эти металлы могут реагировать с окислителями, такими как концентрированный азотная кислота (HNO3), и образовывать соответствующие соли.
Таким образом, типы реакций металлов с кислотами зависят от их активности и химического состава кислоты. Эти реакции могут использоваться для получения солей, выделения водорода или в процессе окисления.
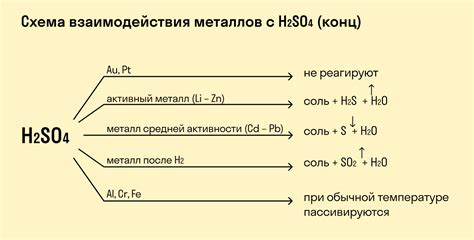
Влияние основных свойств металлов на их реакцию с кислотами
Металлы обладают рядом основных свойств, которые влияют на их реакцию с кислотами. Во-первых, одним из наиболее важных свойств металлов является их электроотрицательность. Это свойство определяет способность металла уступать электроны во время химической реакции. Чем меньше электроотрицательность металла, тем сильнее его реакция с кислотой.
Во-вторых, другим важным свойством металлов является их активность. Активные металлы, такие как натрий или калий, легко реагируют с кислотами, образуя соли и выделяя водород. Более пассивные металлы, такие как серебро или золото, не реагируют с обычными кислотами.
Также стоит отметить, что реакция металла с кислотой может зависеть от концентрации кислоты. Кроме того, некоторые металлы способны реагировать только с определенными типами кислот. Например, активные металлы легко реагируют с сильными минеральными кислотами, такими как соляная или серная кислоты, но не реагируют с органическими кислотами, такими как уксусная кислота.
Таким образом, основные свойства металлов, такие как электроотрицательность и активность, играют важную роль в их реакции с кислотами. Понимание этих свойств помогает предсказать и объяснить характер реакции металлов с кислотами и использовать их в различных химических процессах.
Реакция металлов с неметаллами: основные свойства и примеры
Реакция металлов с неметаллами представляет собой химическое взаимодействие, при котором металлы переходят в окисленное состояние, а неметаллы — в восстановленное. Эта реакция является одной из основных и наиболее изученных в химии.
Одним из свойств реакции металлов с неметаллами является возможность образования ионов металла и неметалла. Металлы, такие как натрий, кальций, магний и другие активные металлы, образуют ионы с положительными зарядами, а неметаллы, например, кислород, сера или хлор, образуют отрицательно заряженные ионы.
Примеры реакций металлов с неметаллами включают взаимодействие меди с кислородом при нагревании, что приводит к образованию оксида меди (II):
2Cu + O2 → 2CuO
Другим примером является реакция алюминия с серой, при которой образуется сульфид алюминия:
2Al + 3S → Al2S3
Реакция металлов с неметаллами широко используется в промышленности и в повседневной жизни. Например, реакция железа с кислородом происходит в атмосфере и вызывает процесс коррозии, или ржавления, металлических предметов. Реакция меди с кислородом приводит к образованию зеленого карбоната меди, который используется как катализатор в различных химических процессах. Также реакции алюминия с различными неметаллами позволяют получать такие вещества, как керамика, керосин и другие промышленные и бытовые материалы.
Классы неметаллов и их взаимодействие с металлами

Неметаллы относятся к основным элементам в периодической системе и могут быть разделены на несколько классов в зависимости от своих физических и химических свойств. Классы неметаллов включают газы, жидкости и твердые вещества.
Главные классы неметаллов включают в себя галогены, кислородосодержащие неметаллы, азотосодержащие неметаллы и инертные газы.
Взаимодействие неметаллов с металлами может быть крайне разнообразным и зависит от конкретных элементов. Некоторые неметаллы, такие как хлор и бром из класса галогенов, могут реагировать с металлами, образуя соли. Это реакция окисления, где неметалл принимает электроны от металла.
Другие неметаллы, такие как кислород, могут образовывать оксиды с металлами при образовании кислородных молекул. При этом неметалл выступает в качестве активного агента, а металл окисляется.
Некоторые неметаллы, например азот из класса азотосодержащих неметаллов, могут образовывать соединения с металлами при образовании азотных молекул. В этом случае неметалл может преобразовываться в ионы и занимать место металла в соединении.
И наконец, инертные газы, такие как гелий и аргон, практически не реагируют с металлами из-за своей высокой стабильности и полной занятости внешней электронной оболочки.
В результате, взаимодействие неметаллов с металлами может быть различным в зависимости от их свойств и электрохимической активности.
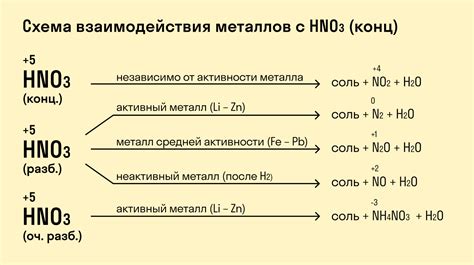
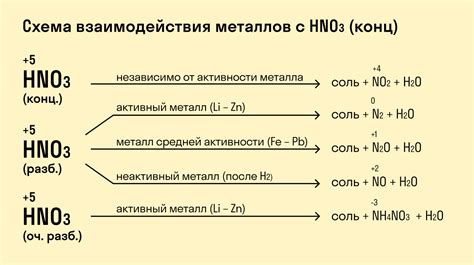
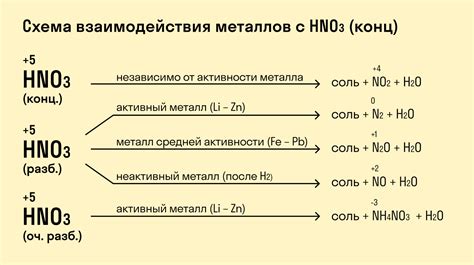
Особенности реакции металлов с сильными и слабыми кислотами
Сильные кислоты, такие как серная, соляная и азотная кислоты, сильно взаимодействуют с металлами. В результате таких реакций образуются соли и выделяются водород. Эта реакция протекает достаточно быстро и сопровождается выделением тепла.
Сильные кислоты, обладая высокой активностью, способны растворять многие металлы, которые обычно нерастворимы в воде. Например, серная кислота реагирует с железом, образуя соль железа(II)сульфат и выделяя сернистый газ:
- Fe + H2SO4 → FeSO4 + H2S
Слабые кислоты, такие как уксусная кислота и угольная кислота, реагируют с металлами медленно и не так интенсивно, как сильные кислоты. При реакции с металлами слабые кислоты образуют соли и выделяются водород, но эта реакция протекает медленнее и не сопровождается таким сильным выделением тепла.
Например, уксусная кислота реагирует с медью, образуя соль меди(II)ацетата и выделяя водород:
- 2CH3COOH + Cu → (CH3COO)2Cu + H2
Таким образом, реакция металлов с кислотами зависит от их силы. Сильные кислоты реагируют интенсивно и быстро, образуя соли и выделяя водород, в то время как слабые кислоты реагируют медленнее и менее интенсивно.
Влияние концентрации кислоты на реакцию с металлом
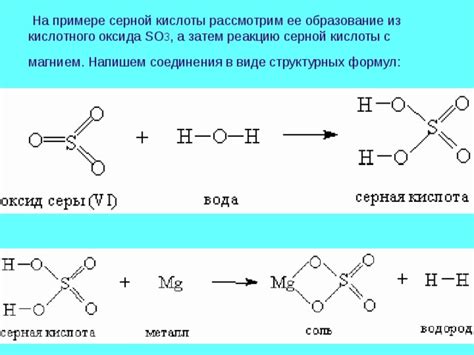
Концентрация кислоты играет важную роль в реакции с металлом. При повышении концентрации кислоты увеличивается количество ионов в растворе, что влияет на скорость реакции. Увеличение концентрации кислоты приводит к ускорению реакции, так как большее количество ионов позволяет большей численности агентов соприкаснуться с поверхностью металла и вступить в реакцию.
Также повышение концентрации кислоты увеличивает кислотность раствора, что обеспечивает более активное взаимодействие кислоты с поверхностью металла. Высокая концентрация кислоты обусловливает большее количество коллизий между частицами металла и ионами кислоты, что способствует ускорению реакции.
Однако при слишком высокой концентрации кислоты может происходить пассивация металла. Пассивация — это процесс образования на поверхности металла тонкой пленки, которая предотвращает дальнейшее реагирование металла с кислотой. Высокая концентрация кислоты может способствовать формированию такой пассивирующей пленки, что замедлит реакцию с металлом или вовсе прекратит ее.
Влияние концентрации кислоты на реакцию с металлом можно наглядно продемонстрировать с помощью таблицы, в которой будут указаны различные концентрации кислоты и скорости реакции с определенным металлом. Это позволит лучше понять, как изменение концентрации кислоты влияет на реакцию с металлом и какие факторы следует учитывать при проведении экспериментов.
Практическое применение реакции металлов с кислотами и неметаллами

Реакция металлов с кислотами и неметаллами имеет широкое практическое применение в различных областях, включая химическую промышленность, медицину и сельское хозяйство.
Одно из практических применений этой реакции - производство солей. Реакция металла с кислотой приводит к образованию соли и выделению водорода. Примером может служить реакция меди с серной кислотой, в результате которой образуется сульфат меди и выделяется водород. Подобные реакции могут быть использованы для получения различных солей, которые находят применение во многих промышленных процессах, включая производство удобрений и пищевых добавок.
Другое применение реакции металлов с кислотами и неметаллами - получение электрохимической энергии в батареях. В электрической батарее металлический анод реагирует с кислотой, что приводит к выделению положительного иона и освобождению электронов. Эти электроны могут быть использованы для создания электрического тока. Примером такой батареи является свинцово-кислотная аккумуляторная батарея, которая широко используется в автомобилях и других электронных устройствах.
Реакция металлов с неметаллами также находит применение в производстве сплавов. Например, реакция железа с углеродом приводит к образованию стального сплава. Этот сплав обладает высокой прочностью и устойчивостью к коррозии, что делает его идеальным материалом для строительства и производства металлических изделий.
Таким образом, практическое применение реакции металлов с кислотами и неметаллами является широким и разнообразным. Оно включает производство солей, получение электрохимической энергии и создание сплавов, которые находят применение в различных отраслях промышленности и технологии.
Вопрос-ответ

Что такое взаимодействие металлов с кислотами и неметаллами?
Взаимодействие металлов с кислотами и неметаллами представляет собой химические реакции, в результате которых металлы могут образовывать соли с кислотами или реагировать с неметаллами.
Какие основные свойства проявляют металлы при взаимодействии с кислотами и неметаллами?
Металлы проявляют следующие свойства при взаимодействии с кислотами и неметаллами: способность отдавать электроны и образовывать ионы положительного заряда, образование солей с кислотами и реакция с неметаллами.
Какие реакции происходят между металлами и кислотами?
Реакции между металлами и кислотами могут приводить к образованию солей и выделению водорода. Например, взаимодействие металла цинка с соляной кислотой приводит к образованию хлорида цинка и выделению водорода.
Какие реакции происходят между металлами и неметаллами?
Реакции между металлами и неметаллами могут приводить к образованию соединений, таких как оксиды и сульфиды. Например, взаимодействие металла натрия с хлором приводит к образованию хлорида натрия.

