Взаимодействие металлов с кислотами – это процесс, в результате которого металлы реагируют с кислотами, образуя соли и выделяя водородный газ. Этот процесс имеет большое значение в химии и промышленности, так как металлы используются в различных областях, а кислоты – в качестве реагентов и катализаторов.
Взаимодействие металлов с кислотами основано на особенностях строения и химических свойствах этих веществ. Металлы представляют собой ионы, обладающие положительным зарядом, а кислоты – молекулы, содержащие водородный ион (протон) и отрицательно заряженные ионы, называемые анионами.
В процессе реакции металл с кислотой образует соль металла и водородный газ. Это объясняется тем, что металл замещает в кислоте водород и образует стабильную соль. Образование соли металла происходит за счет соединения ионов металла с анионами из кислоты. Выделение водорода объясняется тем, что металлический ион генерирует электроны, которые реагируют с протонами водородного иона, образуя молекулы водородного газа.
Металлы и их свойства

Металлы являются основным классом химических элементов, обладающих рядом уникальных свойств, придающих им особую практическую значимость. Они обладают высокой тепло- и электропроводностью, а также способностью образовывать легкозаплавные сплавы. Металлы отличаются хорошей пластичностью, что позволяет из них создавать различные конструкции и изделия методом литья, ковки, проката и других технологий.
Все металлы обладают металлическим блеском, который связан с их способностью отражать свет. Они обладают достаточно высокой плотностью, что делает их тяжелыми по сравнению с другими типами веществ. Многие металлы обладают также высокой прочностью, что позволяет им выдерживать большие механические нагрузки без разрушения.
Металлы также обладают способностью образовывать ионы положительного заряда, что позволяет им образовывать множество соединений с другими элементами. Некоторые металлы реагируют с кислотами, образуя соли и выделяя водород. Это свойство можно использовать для исследования взаимодействия металлов с кислотами и изучения их химических свойств.
Виды кислот и их химические свойства
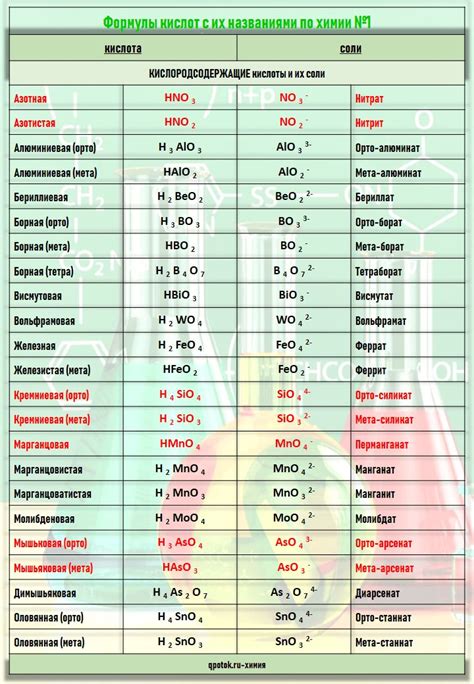
Кислоты – это вещества с кислотными свойствами, т.е. они способны образовывать положительные ионы в растворе. Часто используемые виды кислот включают соляную кислоту, серную кислоту, солянокислый, уксусный и гидроксипропионовый кислоты.
Соляная кислота (HCl) является одной из самых распространенных и сильных кислот. Она образуется при соединении хлорида натрия (NaCl) с серной кислотой (H2SO4). Соляная кислота обладает ярко выраженными коррозионными свойствами и может разрушать металлы, такие как железо, алюминий и цинк.
Серная кислота (H2SO4) также является сильной кислотой и имеет широкий спектр применения в различных отраслях, включая производство удобрений, пластмасс и красителей. Она обладает агрессивными коррозионными свойствами и способна реагировать с большим количеством металлов, образуя с ними соли и выделяя водородный газ.
Солянокислый (HNO3) и уксусный (CH3COOH) кислоты являются слабыми кислотами и менее активны в отношении металлов. Однако они все равно могут вызывать коррозию при длительном взаимодействии с некоторыми металлами. Гидроксипропионовая кислота (C3H6O3) – это слабая кислота, которая образуется при смешивании пропионовой кислоты с водой.
Химические реакции между металлами и кислотами

Химические реакции между металлами и кислотами являются фундаментальными процессами в химии. При взаимодействии металлов с кислотами происходит образование солей и выделение водорода.
Металлы, являясь активными элементами, реагируют с кислотами, которые выступают в качестве окислителей. В результате химической реакции происходит окисление металла и понижение степени окисления кислоты. Например, взаимодействие цинка с соляной кислотой приводит к образованию хлорида цинка и выделению водорода:
2HCl + Zn → ZnCl₂ + H₂
При этом водород освобождается в виде газа, что может проявиться в виде пузырьков при взаимодействии металла с кислотой.
Химические реакции между металлами и кислотами важны не только с точки зрения изучения основ химии, но и имеют практическое применение. Например, взаимодействие алюминия с соляной кислотой используется для очистки поверхности алюминиевых изделий от окислов и других загрязнений.
Образование солей при взаимодействии металлов с кислотами

При взаимодействии металлов с кислотами образуются соли – химические соединения, состоящие из металла и иона кислоты. Это происходит благодаря реакции обмена, при которой ионы металла замещают протон кислоты.
Образование солей при взаимодействии металлов с кислотами происходит в несколько этапов. Сначала происходит ионизация кислоты, то есть ее распад на положительный ион водорода и отрицательный ион аниона. Затем металл реагирует с анионом кислоты, образуя нерастворимую соль или соль, которая растворяется в воде.
Соли, образовавшиеся при взаимодействии металлов с кислотами, могут иметь различные свойства. Некоторые из них могут быть растворимыми в воде и обладать хорошей электропроводностью, а другие – быть нерастворимыми и малоактивными. Кроме того, свойства солей зависят от типа кислоты и металла, участвующих в реакции.
Образование солей при взаимодействии металлов с кислотами имеет широкое применение в различных областях. Соли используются в химической промышленности для производства удобрений, пластмасс, красителей и других веществ. Они также находят применение в медицине, пищевой промышленности и косметологии.
Реакции гидролиза при взаимодействии металлов с кислотами

Взаимодействие металлов с кислотами приводит к реакции гидролиза, при которой металлы образуют гидроксиды и выделяется водород. Гидролиз является химической реакцией, при которой вода расщепляется на ионы и оказывает влияние на среду реакции.
В реакции гидролиза происходит образование гидроксидов металлов. Гидроксиды обладают основными свойствами и могут образовывать основание с водой. При реакции гидролиза металлы могут образовывать как слабые гидроксиды, так и сильные основания.
При взаимодействии металла с кислотой происходит образование соли и выделение водорода. Водород образуется за счет гидролиза воды, который происходит на поверхности металла. Эта реакция является химической реакцией окисления-восстановления, в которой металл вступает в реакцию с водородом из кислоты.
Реакции гидролиза при взаимодействии металлов с кислотами являются важным физико-химическим процессом. Они применяются в различных отраслях промышленности, таких как производство водорода, электрохимические и гальванические процессы, а также в химическом анализе для детектирования металлов и кислот.
Коррозия металлов в кислотной среде
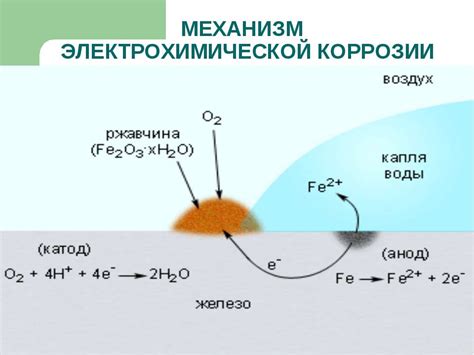
Коррозия металлов в кислотной среде является одним из основных факторов, приводящих к разрушению металлических конструкций и оборудования. При контакте металла с кислотой происходит химическая реакция, в результате которой происходит изнашивание и разрушение металла.
Первоначально происходит растворение представляющего коррозионную среду вещества. Затем начинается проникновение кислоты в структуру металла, что приводит к образованию коррозионных продуктов и облегчает дальнейшую проникновение кислоты вглубь металла.
При коррозии металла в кислотной среде образуются недрастяжительные оксиды, которые затрудняют процесс дальнейшего разрушения металла. Однако, к таким оксидам могут присоединяться другие вещества, что может приводить к образованию новых оксидов и продолжению процесса коррозии.
Устойчивость металлов к коррозии в кислотной среде напрямую зависит от их химической структуры и активности. Например, алюминий и цинк являются активными металлами и быстро корродируют при контакте с кислотой, в то время как нержавеющая сталь обладает высокой стойкостью к коррозии.
Практическое применение реакций между металлами и кислотами

Реакции между металлами и кислотами обладают широким практическим применением в различных отраслях промышленности и быта. Они являются основой процессов гальванизации, при которых на поверхность металла осаждают металлическое покрытие.
Также эти реакции используются в производстве различных химических соединений. Например, реакция между цинком и серной кислотой приводит к образованию сернокислого цинка, который широко применяется в гальванической промышленности для защиты металлических изделий от коррозии.
Кроме того, реакции между металлами и кислотами находят применение в батарейках и аккумуляторах. В таких устройствах энергия выделяется при окислении металлического анода, который находится в контакте с кислотным электролитом.
Некоторые реакции металлов с кислотами могут использоваться для очистки поверхности металлических изделий от оксидных пленок. Например, реакция алюминия с соляной кислотой позволяет удалить оксидный слой с поверхности алюминиевых изделий, делая их более чистыми и готовыми к дальнейшей обработке или использованию.
Вопрос-ответ

Что такое взаимодействие металлов с кислотами?
Взаимодействие металлов с кислотами - это процесс, при котором металл вступает в реакцию с кислотой, образуя соль и выделяя водород.
Какие металлы реагируют с кислотами?
Реагировать с кислотами могут металлы, имеющие положительный электродный потенциал, такие как цинк, железо, алюминий и др.
Что происходит при взаимодействии металлов с кислотами?
При взаимодействии металлов с кислотами происходит окислительно-восстановительная реакция, в результате которой металл окисляется, а кислород восстанавливается.
