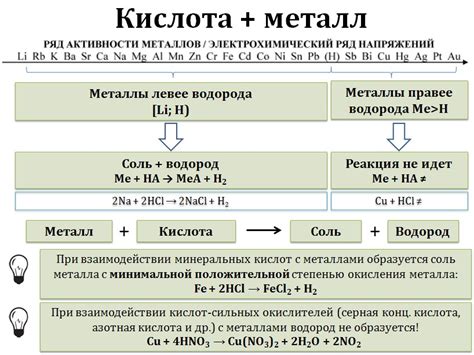
Реакция металлов с кислотами – одна из основных химических реакций, которая часто встречается во время изучения общей химии. В результате этой реакции происходит обмен протонов между металлом и кислотой. Особенности взаимодействия металлов с кислотами связаны с их химическими свойствами и способностью образовывать ионы.
При реакции металлов с кислотами обычно выделяется водород и образуется соответствующая соль. Например, при взаимодействии цинка с соляной кислотой образуется хлорид цинка и выделяется водородный газ по следующему уравнению:
Zn + 2HCl → ZnCl2 + H2
Однако не все металлы реагируют одинаково с кислотами. Важную роль играют их электрохимические свойства, такие как потенциал окисления и способность образовывать ионы в растворе кислоты. Например, активные металлы, такие как натрий или калий, реагируют с водой, а не с кислотами. Это связано с их способностью образовывать ионы гидроксида, а не соль при реакции с водой.
Реакция металлов с кислотами имеет не только академическое значение, но и широкое применение в различных областях науки и техники. Например, эта реакция используется для получения водорода – энергетически выгодного газа, который активно применяется в различных отраслях промышленности и транспорта. Также реакция металлов с кислотами может являться химическим тестом для идентификации металлов и их присутствия в различных средах.
Что такое реакция металлов с кислотами
Реакция металлов с кислотами - это химический процесс, при котором металлы взаимодействуют с кислотами, образуя соли и выделяя газы.
В результате реакции металлов с кислотами образуются соли, которые представляют собой химические соединения металлов и кислот. Соли имеют ионную природу и обладают определенными физическими и химическими свойствами.
Во время реакции металлы могут выделять различные газы, такие как водород, оксиды азота, диоксид серы и др. Выделение газов является одним из характерных признаков реакции металлов с кислотами и может сопровождаться шипением или пением.
Реакция металлов с кислотами происходит на основе дисплейсии и обусловлена разностью активности металла и водорода, который выступает в роли окислителя. Металлы, обладающие большей активностью, реагируют с кислотами более интенсивно и способны вытеснить из кислоты водород.
Таблица активности металлов позволяет определить, какой металл будет проявлять большую активность при взаимодействии с кислотами, а также предсказать результаты реакции. Например, металлы из группы щелочных металлов (натрий, калий) проявляют высокую активность и могут реагировать с водой и кислотами с образованием газа.
Важность изучения реакции металлов с кислотами

Изучение реакции металлов с кислотами является важным этапом в изучении химии и позволяет установить основные закономерности и принципы взаимодействия этих веществ. Эта тема имеет практическое значение, так как позволяет предсказывать результаты химических реакций и определять возможность получения нужных продуктов.
Реакция металлов с кислотами основывается на принципах окисления-восстановления и обладает большим научным и практическим интересом. Изучение этого процесса помогает понять, как происходит образование растворимых солей и выделение газов, а также разложение нерастворимых веществ. Оно предоставляет возможность получать и использовать металлы в промышленности, а также определять их активность и степень взаимодействия.
Знание реакции металлов с кислотами позволяет проводить анализ металлических соединений, определять их состав и качество. Это также важно для разработки новых технологий и материалов, которые могут быть использованы в различных отраслях промышленности, включая строительство, энергетику, медицину и другие области.
Следует отметить, что реакция металлов с кислотами имеет не только научное, но и образовательное значение. Она позволяет студентам углубить свои знания в области химии, развить навыки экспериментирования и лабораторной работы, а также научиться анализировать и интерпретировать полученные результаты.
В заключение, изучение реакции металлов с кислотами является важной задачей в химии. Оно позволяет понять основные принципы взаимодействия металлов и кислот, предсказывать результаты химических реакций, использовать полученные знания в практических целях и развивать научные и образовательные навыки.
Взаимодействие металлов с кислотами: основные законы

Взаимодействие металлов с кислотами основано на законах химической реакции и принципах термодинамики. При контакте металлов с кислотами происходит образование солей и выделение водорода.
Основными законами взаимодействия являются законы сохранения массы и энергии. В соответствии с законом сохранения массы, масса вещества в реакции остается постоянной и равной сумме масс исходных веществ. Это означает, что при реакции металла с кислотой масса соли и выделившегося водорода равна массе исходных веществ.
Закон сохранения энергии подразумевает, что энергия между системой (металлом и кислотой) и окружающей средой также остается постоянной. В процессе реакции металла с кислотой происходит выделение тепла, что может проявляться в виде нагрева реагирующих веществ или продуктов реакции.
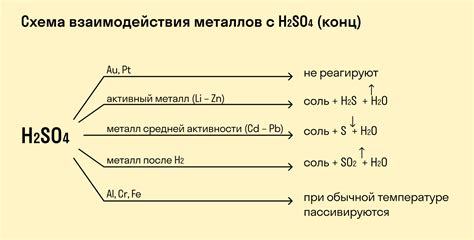
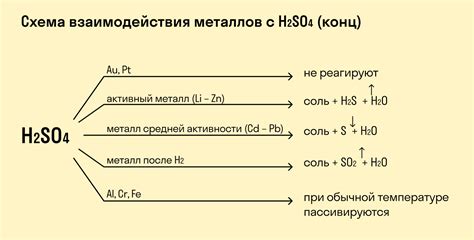
Взаимодействие металлов с кислотами может быть различным в зависимости от химических свойств металла и кислоты. Некоторые металлы, такие как алюминий или цинк, активно взаимодействуют с кислотами, выделяя водород и образуя соответствующие соли. Другие металлы, такие как золото или серебро, кислотами не реагируют и остаются стабильными в таких средах.
Таким образом, взаимодействие металлов с кислотами следует основным законам химической реакции и термодинамики, и может быть различным в зависимости от свойств металла и кислоты. Этот процесс имеет практическое значение в химической промышленности и может использоваться для получения солей и выделения водорода.
Функции кислот в реакции с металлами
Кислоты играют важную роль в химической реакции с металлами. Они выступают в качестве реагента, обеспечивая необходимые условия для взаимодействия с металлом.
Одна из функций кислот в реакции с металлами - образование солей. Когда кислота вступает в реакцию с металлом, происходит обмен ионами. Кислота отдает положительный ион, а металл - отрицательный ион. Эти ионы соединяются, образуя соль. Примером такой реакции может быть взаимодействие серной кислоты с цинком:
H2SO4 + Zn → ZnSO4 + H2
Другая функция кислот - образование водорода. В некоторых реакциях с металлами, кислота выступает в качестве окислителя и отдает электроны. При этом металл приобретает положительный заряд и образует положительный ион. Отданные кислотой электроны соединяются в молекулы водорода. Например, при взаимодействии соляной кислоты (HCl) с цинком, образуется хлорид цинка и молекулы водорода:
2HCl + Zn → ZnCl2 + H2
Кроме того, кислоты могут определять скорость и характер реакции с металлами. Реакция может протекать более интенсивно или замедленно в зависимости от концентрации и активности кислоты. Также, некоторые кислоты, например, соляная или хлороводородная, могут образовывать пассивирующие слои на поверхности металла, что препятствует дальнейшей реакции.
Взаимодействие металлов с кислотами является важным процессом в химии и применяется в различных областях, включая промышленность и научные исследования.
Реакционные способности различных металлов
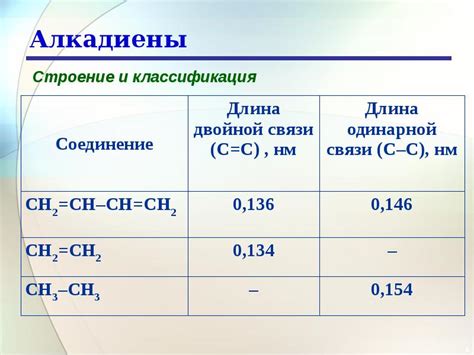
Реакция металлов с кислотами является одной из фундаментальных реакций, которая позволяет изучать химические свойства различных металлов. Каждый металл обладает своей специфической реакционной способностью, которая определяется его электрохимическим потенциалом.
Наиболее реакционноспособные металлы, такие как натрий, калий, кальций и магний, обладают отрицательным электрохимическим потенциалом и легко реагируют с кислотами. При этом они выделяются водородный газ и образуют соответствующие соли.
Некоторые металлы, такие как железо и цинк, обладают меньшей реакционной способностью и реагируют с кислотами только при нагревании. При этом в результате реакции образуется водородный газ и соответствующие соли металлов.
Некоторые металлы, такие как алюминий и свинец, реагируют с сильными кислотами (например, соляной кислотой) только при нагревании. Однако, они не реагируют с уксусной кислотой. Реакция металла с кислотой протекает с образованием водородного газа и соли.
Инертные металлы, такие как золото и платина, не реагируют с кислотами в обычных условиях. Однако, даже они могут реагировать с некоторыми кислотами при повышенных температурах или в других условиях.
Сравнивая реакционные способности различных металлов с кислотами, можно сделать вывод о различной активности их химических свойств, что находит применение в различных областях науки и техники.
Изменения веществ при реакции металлов с кислотами
Реакция металлов с кислотами приводит к изменениям состава и свойств веществ, участвующих в этом процессе. В результате такой реакции образуются соли и выделяется водородный газ.
Первым этапом данного процесса является диссоциация кислоты в водном растворе, образуя ион гидроксония H3O+. Далее ион гидроксония реагирует с металлом, образуя соль и выделяя водородный газ H2.
Соль, образовавшаяся при реакции, имеет общую формулу M(H2O)n, где M - металл, а n - число водных молекул, которые непрерывно ассоциированы с основным катионом. В зависимости от типа кислоты и металла, образующейся соль может быть неподвижной или безводной.
Образование водородного газа является характерной чертой реакции металлов с кислотами. Это объясняется тем, что между ионом гидроксония и металлом протекает реакция обмена, в результате которой металл обеспечивает донорное вещество в формировании водорода, а ион гидроксония выступает в роли акцептора электронной пары.
Таким образом, реакция металлов с кислотами приводит к образованию солей и выделению водородного газа. Этот процесс является важным с точки зрения промышленной химии и науки, поскольку позволяет получать различные металлические соединения и является одним из путей их синтеза.
Практическое применение реакции металлов с кислотами
Реакция металлов с кислотами имеет широкое практическое применение в различных областях. Одним из основных применений является получение водорода - незаменимого вещества в промышленности и научных исследованиях.
Водород, образующийся при реакции металла с кислотой, используется в процессе гидрогенизации органических соединений, в производстве аммиака и других химических соединений. Он также применяется как энергетическое топливо в топливных элементах и водородных двигателях, благодаря своей высокой энергетической плотности и экологической чистоте.
Реакция металлов с кислотами также используется для получения солей металлов. К примеру, получение серной кислоты - одного из самых важных химических соединений - происходит посредством реакции серы с кислородом, которую можно провести при помощи металлического катализатора. Также, путем реакции металлов с кислотами возможно получение целого ряда солей, которые находят применение в производстве лекарств, пищевой промышленности и других сферах.
Реакция металлов с кислотами может быть использована для очистки металлических поверхностей от ржавчины и различных загрязнений. При взаимодействии кислот с поверхностями металлов происходит образование растворимых солей, которые затем могут быть удалены простым смыванием. Данная технология широко используется в промышленности и бытовых условиях для очистки металлических изделий и деталей.
Предосторожности при работе с металлами и кислотами

Работа с металлами и кислотами требует особой внимательности и соблюдения определенных предосторожностей. При проведении экспериментов необходимо следовать правилам личной безопасности, чтобы избежать возможных аварий и травм.
Во-первых, необходимо обладать знаниями о свойствах конкретного металла и кислоты, с которыми вы работаете. Изучите их еще до начала эксперимента, чтобы понимать, какие реакции могут произойти и какие последствия они могут иметь.
Во-вторых, всегда работайте в хорошо проветриваемом помещении или под вытяжным шкафом, чтобы избежать вдыхания опасных паров или газов. Используйте специальные защитные очки, перчатки и фартук, чтобы защитить себя от попадания кислоты или частичек металла на кожу или в глаза.
Третье, будьте особенно осторожны при работе с концентрированными кислотами и реактивами. Избегайте их попадания на открытые участки кожи и воздействия на слизистые оболочки. При попадании кислоты на кожу немедленно промойте ее большим количеством воды и обратитесь за медицинской помощью при необходимости.
Четвертое, помните о правильной работы со всеми инструментами и оборудованием. Никогда не работайте с металлами или кислотами в близости от открытого огня или источников возгорания. Также следите за расположением и закреплением емкостей с кислотами, чтобы они не перевернулись и не пролились.
Важно иметь под рукой необходимые средства для нейтрализации и ликвидации аварийных ситуаций. Заранее подготовьте растворы для нейтрализации и утилизации кислот и знайте, как ими пользоваться. Это поможет вам быстро и эффективно положить конец несчастному случаю или предотвратить его возникновение вообще.
Вопрос-ответ

Какие металлы реагируют с кислотами?
Реагировать с кислотами могут различные металлы, включая щелочные и щелочноземельные металлы. К ним относятся натрий, калий, магний и кальций. Также реагировать с кислотами могут некоторые переходные металлы, такие как железо и алюминий.
Как происходит реакция металлов с кислотами?
Реакция металлов с кислотами основывается на обмене ионами. Когда металл взаимодействует с кислотой, происходит образование соли и выделение водорода. Например, если взять цинк и соляную кислоту, будет образован цинк хлорид и выделен водородный газ: Zn + 2HCl -> ZnCl2 + H2.
Почему некоторые металлы реагируют с кислотами, а некоторые - нет?
Способность металла реагировать с кислотами зависит от его химической активности. Щелочные и щелочноземельные металлы обладают большой химической активностью и легко реагируют с кислотами. Некоторые переходные металлы, такие как железо и алюминий, также могут реагировать с кислотами, но их активность ниже.
Какие опасности могут возникнуть при реакции металлов с кислотами?
При реакции металлов с кислотами могут возникать опасные вещества и условия. Например, при реакции цинка с соляной кислотой выделяется хлороводородный газ, который является ядовитым и может вызвать ожоги. Также, при реакции металлов с сильными кислотами, может возникать выделение большого количества тепла, что может привести к пожарам или взрывам.
Какое применение имеет реакция металлов с кислотами в промышленности?
Реакция металлов с кислотами имеет широкое применение в промышленности. Например, она используется для получения различных солей, которые могут быть использованы в производстве удобрений, пищевых добавок, лекарственных препаратов и других химических соединений. Также, реакция металлов с кислотами может использоваться для очистки металлических поверхностей от окислов и загрязнений.
