Металлы являются одним из основных классов химических элементов и присутствуют во множестве ежедневных объектов и материалов, таких как монеты, провода, кухонная посуда и строительные материалы. Однако, они также могут стать предметом химических реакций, особенно при взаимодействии с кислородом.
Реакция металлов с кислородом может проявляться в различной степени, от слабого окисления до интенсивного горения. Некоторые металлы могут при реакции с окружающим кислородом образовывать оксиды, которые имеют различные свойства и применения. Для более полного понимания взаимодействия металлов с кислородом была разработана таблица, которая отражает их химическое поведение.
Таблица взаимодействия металлов с кислородом представляет собой обзорные данные о реакции каждого металла с кислородом и получающихся оксидах. Она позволяет определить, какой металл окисляется, какая степень окисления образуется, а также какие свойства и применения имеет полученный оксид.
Металлы, способные существовать в свободном состоянии в природе

В природе существует множество металлов, которые могут существовать в свободном состоянии, то есть не связанными с другими элементами. Такие металлы называются добывающимися. Они обладают высокой химической активностью и относятся к первым металлам-проявителям в периодической системе элементов.
Главным представителем этой группы металлов является железо (Fe). Оно широко распространено в природе и встречается в виде нативного железа. Железо - один из самых важных элементов для человечества. Оно используется в строительстве, производстве стали, машиностроении и др.
Еще одним примером металла, способного существовать в свободном состоянии в природе, является медь (Cu). Она также широко распространена и встречается в природе в виде нативной меди. Медь используется для производства проводов, монет, украшений и др.
Также можно отметить алюминий (Al), который также может существовать в свободном состоянии. Алюминий имеет низкую плотность и высокую прочность, поэтому он нашел широкое применение в авиационной и космической промышленности, а также в производстве упаковки и строительных материалов.
В таблице взаимодействия металлов с кислородом эти металлы обозначаются зеленым цветом, что указывает на их способность образовывать оксиды и существовать в свободном состоянии в природе.
Металлы, образующие соединения с кислородом

Металлы являются химическими элементами, которые могут образовывать соединения с кислородом. Это происходит в результате окисления металлов, при котором они реагируют с кислородом из воздуха или других источников.
Оксиды металлов являются одним из наиболее распространенных типов соединений, образующихся при реакции металлов с кислородом. Они могут иметь различные степени окисления металла и структурные формы. Некоторые из наиболее известных оксидов металлов включают оксид железа (Fe2O3), оксид алюминия (Al2O3), оксид кальция (CaO), оксид меди (CuO) и оксид цинка (ZnO).
Кроме оксидов, металлы также могут образовывать пероксиды и супероксиды при реакции с кислородом. Например, пероксид водорода (H2O2) является пероксидом, а пероксид бария (BaO2) и супероксид калия (KO2) являются пероксидами и супероксидами соответственно.
Взаимодействие металлов с кислородом в реакции окисления может приводить к образованию различных окислительно-восстановительных реакций, включая реакцию с каталитическими свойствами и образование ионов металла с разными степенями окисления.
Таблица взаимодействия металлов с кислородом представляет собой удобный инструмент для анализа и сравнения химической активности металлов при реакции с кислородом. В этой таблице перечислены различные металлы и их способность образовывать соединения с кислородом в виде оксидов, пероксидов и супероксидов.
Оксиды металлов: свойства и применение
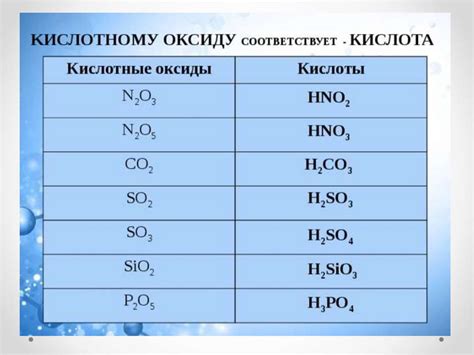
Оксиды металлов представляют собой соединения металлов с кислородом. Эти соединения обладают рядом характерных свойств, которые определяют их применение в различных отраслях науки и промышленности.
Одним из основных свойств оксидов металлов является их химическая активность. Они легко реагируют с водой, кислотами и другими химическими веществами. Некоторые оксиды металлов обладают также кислотными или щелочными свойствами.
Применение оксидов металлов разнообразно. Например, оксид железа, известный как ржавчина, используется в качестве красящего вещества в производстве красок и пигментов. Оксид алюминия, или глинозем, используется в производстве керамики, стекла и алюминиевой фольги. Оксид меди, или медный (II) оксид, находит применение в производстве электродов для аккумуляторов и электропроводящих покрытий.
Оксиды металлов также являются важными катализаторами в химических процессах. Например, оксид меди применяется в производстве синтетического аммиака, а оксид железа – в производстве синтетического бензина.
Другим важным свойством оксидов металлов является их способность растворяться в воде. Некоторые оксиды образуют основные растворы, а некоторые – кислотные. Это свойство находит применение в аналитической химии, при проведении различных химических анализов.
Водородные оксиды: свойства и применение
Водородные оксиды – это соединения водорода с кислородом, которые обладают различными свойствами и могут быть использованы в разных областях.
Одним из наиболее известных и широко применяемых водородных оксидов является вода (H2O). Вода является неотъемлемой частью жизни на Земле и необходима для поддержания жизнедеятельности всех организмов. Она обладает уникальными свойствами, такими как высокая теплоемкость, хорошая растворимость различных веществ и способность выступать в роли растворителя. Вода также используется в различных отраслях промышленности, например, в процессах охлаждения и очистки.
Другим важным водородным оксидом является перекись водорода (H2O2). Это мощное окислительное вещество, которое широко используется в медицине, бытовых целях и промышленности. В медицине перекись водорода применяется для дезинфекции ран и поверхностей, а также для отбеливания зубов. В бытовых целях она используется для удаления пятен с одежды и отбеливания поверхностей. В промышленности перекись водорода используется как окислитель, отбеливатель, стабилизатор и катализатор в различных процессах.
Еще один важный водородный оксид – пароводород (H2O2). Это газообразное вещество, которое обладает мощным окислительным и разрушающим действием. В сельском хозяйстве пароводород используется для обработки почвы и семян, а также для дезинфекции воды и поверхностей. В промышленности пароводород используется в качестве агента отбеливания, дезинфицирующего средства, а также в процессах производства эпоксидных смол и перекиси водорода.
Водородные оксиды имеют широкое применение в различных отраслях науки, медицины, промышленности и быта. Благодаря своим уникальным свойствам и разнообразию возможных применений, водородные оксиды остаются неотъемлемой частью нашей повседневной жизни. Исследование и разработка новых водородных оксидов являются важной задачей для улучшения наших жизненных условий и развития современных технологий.
Пероксиды и супероксиды металлов: особенности и применение

Пероксиды и супероксиды металлов – это соединения, в которых металл образует связь с кислородом, превышающую нормальное значение (-2 в случае пероксидов и -1,5 в случае супероксидов).
Особенностью пероксидов является наличие двухатомного кислорода в молекуле. Например, пероксид водорода H2O2 – это самый известный пероксид. Он может быть использован в качестве окислителя, а также в медицине.
Супероксиды металлов, в свою очередь, содержат одноатомный кислород в молекуле. Они характеризуются высокой реакционной способностью и участвуют в таких процессах, как окисление воды. Некоторые супероксиды металлов, например, пероксид калия (K2O2), находят применение в химической промышленности, в качестве источника кислорода или катализатора реакций.
Обладая уникальными физико-химическими свойствами, пероксиды и супероксиды металлов находят применение в различных отраслях науки и промышленности. Изучение реакций этих соединений расширяет наши знания о химических свойствах металлов и позволяет использовать их в разнообразных процессах для достижения желаемых результатов.
Металлы, не образующие соединения с кислородом
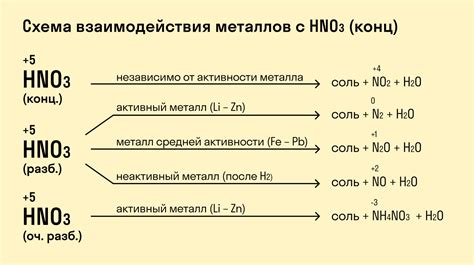
Некоторые металлы не образуют соединений с кислородом при нормальных условиях. Это связано с их высокой химической инертностью в отношении к кислороду.
Одним из таких металлов является золото. Оно не окисляется на воздухе и не образует оксиды. Это свойство делает его ценным материалом для ювелирных изделий и монет.
Серебро также относится к металлам, не образующим соединения с кислородом при нормальных условиях. Однако оно может быть окислено при взаимодействии с серной кислотой или другими сильными окислителями.
Платина и палладий также примеры металлов, не образующих соединений с кислородом. Они обладают высокой химической стойкостью и используются в катализаторах, электроде некоторых электрохимических систем и других высокотехнологических областях.
Есть также металлы, которые очень медленно окисляются на воздухе, но все же могут образовать соединения с кислородом при высоких температурах или в условиях, несвойственных обычным рабочим условиям. Например, алюминий может образовывать оксиды при высоких температурах или в присутствии влаги, но при комнатной температуре остается стабильным.
Роль металлов в биохимии и экологии

Металлы играют важную роль в биохимии и экологии, оказывая влияние на различные процессы и функции в природе. Они являются неотъемлемой частью многих белков, ферментов и других молекул, выполняющих жизненно важные функции в организмах.
Биологически активные металлы – это металлы, которые необходимы для правильного функционирования организмов и регулирования различных процессов. Они присутствуют во многих ферментах, играя роль катализаторов химических реакций. Например, цинк участвует в активности около 300 различных ферментов, включая ферменты, ответственные за обмен веществ и иммунные реакции.
Металлы также важны для поддержания стабильности белков и ДНК. Железо, например, является неотъемлемой частью гемоглобина, который переносит кислород в организме. Медь и цинк также участвуют в структуре и функционировании металлопротеинов, обеспечивая эффективную работу организма.
Однако, не все металлы полезны для организмов. Существуют также токсичные металлы, которые могут негативно влиять на здоровье живых существ и экосистемы. Они могут накапливаться в тканях организма и вызывать различные патологические состояния. Например, ртуть является известным токсичным металлом, который может накапливаться в рыбе и при попадании в организм человека вызывать серьезные проблемы со здоровьем.
Металлы также влияют на экологию и биоразнообразие. Они являются неотъемлемой частью пищевых цепей и экосистем, где они выполняют роль как питательных веществ, так и токсинов. Повышенное содержание определенных металлов в почве или воде может привести к загрязнению и разрушению экосистемы, а также иметь отрицательное воздействие на животный и растительный мир.
Таким образом, металлы играют важную роль в биохимии и экологии, обеспечивая правильное функционирование организмов и экосистем. Однако, необходимо соблюдать баланс и контролировать содержание металлов в окружающей среде, чтобы предотвратить негативные последствия для живых существ и природы в целом.
Вопрос-ответ

Какие металлы реагируют с кислородом?
С кислородом реагируют многие металлы, включая алюминий, железо, медь, золото и другие. Но степень и скорость их реакции зависит от конкретного металла.
Как проявляется реакция металлов с кислородом?
При реакции металлов с кислородом происходит окисление металла, что приводит к образованию оксида металла. Некоторые металлы могут реагировать с кислородом даже при обычных условиях, особенно активные металлы, такие как литий или натрий.
Каков реакционный ряд металлов с кислородом?
Реакционный ряд металлов с кислородом описывает их способность реагировать с кислородом и указывает на их активность. Наиболее активные металлы находятся в начале ряда, например, литий и натрий, а наименее активные металлы находятся в конце ряда, например, серебро и золото.
Какие оксиды образуются при реакции металлов с кислородом?
Реакция металлов с кислородом приводит к образованию оксидов металлов. Например, алюминий образует оксид алюминия (Al2O3), железо - оксид железа (Fe2O3), медь – оксид меди (CuO) и так далее.
Может ли реакция металла с кислородом протекать в обратном направлении?
Реакция металла с кислородом, при которой образуется оксид металла, называется окислительной реакцией. Теоретически, при определенных условиях, оксид металла может реагировать с кислородом, освобождая металл. Однако в ряде металлов подобная реакция протекает с трудом или не протекает совсем.
