Металлы – это элементы, которые обладают высокой термической и электрической проводимостью, а также обычно имеют блестящую поверхность. Взаимодействие металлов с кислородом является одним из основных процессов, определяющих их химические свойства и вариативность их соединений. При контакте с кислородом происходит окисление металла, что может приводить к образованию окисей, оксидов и супероксидов.
Одним из самых известных примеров взаимодействия металла с кислородом является процесс коррозии железа, при котором железо, под воздействием кислорода и влаги, превращается в железоокись. Химическая формула этого соединения Fe2O3 наглядно демонстрирует присутствие двух атомов железа и трех атомов кислорода.
Существует множество примеров взаимодействия других металлов с кислородом. Например, при нагревании меди в присутствии кислорода образуется оксид меди Cu2O, а алюминий при окислении получает оксид Al2O3, который используется в качестве катализатора в ряде химических реакций.
Взаимодействие металлов с кислородом может иметь не только отрицательные последствия, но и положительные применения. Например, процесс, при котором металлы образуют оксиды, используется в производстве цемента, стекла и различных керамических материалов. Кроме того, металлы окисляются для создания защитных покрытий, которые предотвращают дальнейшую коррозию и повреждение поверхности металлических изделий.
Металлы и их взаимодействие с кислородом
Металлы - это класс элементов, характеризующихся своей проводимостью электричества и тепла. Они обладают особыми свойствами взаимодействия с кислородом. Воздействие кислорода на металлы может привести к образованию оксидов металла, что часто вызывает изменение их физических и химических свойств.
Наиболее известным примером взаимодействия кислорода с металлом является окисление железа, которое приводит к образованию ржавчины. Железо реагирует с кислородом воздуха, образуя соединение Fe₂O₃, известное как гематит. Это пример окислительной реакции, при которой железо теряет электроны, а кислород приобретает их. Таким образом, взаимодействие металлов с кислородом называется окислительной реакцией.
Однако не все металлы реагируют с кислородом таким образом. Например, металлы, такие как золото и платина, обладают высокой устойчивостью к окислению и не образуют оксидов при взаимодействии с кислородом. Такие металлы считаются коррозионностойкими и широко используются в ювелирном и электронном производстве.
Некоторые металлы, например, алюминий и магний, имеют способность образовывать оксидные пленки при взаимодействии с кислородом. Эти пленки обладают защитными свойствами и предотвращают дальнейшее окисление металла. Такие металлы называют пассивированными и также широко используются в промышленности.
Взаимодействие металлов с кислородом является сложной химической реакцией, которая может быть использована как для получения полезных соединений, так и привести к возникновению нежелательных процессов, таких как коррозия. Понимание этих процессов позволяет эффективно управлять взаимодействием металлов с кислородом и использовать их свойства в различных областях промышленности и научных исследований.
Металлический элемент кислород

Металлический элемент кислород - это вещество, состоящее из одного атома металла и двух атомов кислорода. Это соединение имеет химическую формулу, которая показывает соотношение атомов вещества.
Металлический элемент кислород обладает рядом химических свойств, которые делают его очень полезным и важным для различных применений. Он может образовывать разнообразные соединения с другими элементами и соединениями, такими как металлы, неметаллы и органические соединения.
Металлический элемент кислород широко используется в различных областях, таких как металлургия, электроника, химическая промышленность и многие другие. Он играет важную роль в процессах окисления и восстановления, а также в реакциях с кислотами и основаниями.
В жидком состоянии металлический элемент кислород обладает синевато-голубой окраской. Он является сильным окислителем и может вызывать горение, поэтому его использование требует особой осторожности и меры предосторожности.
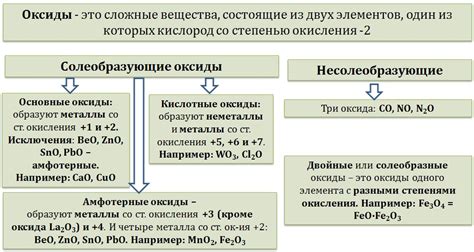
Химические формулы оксидов металлов
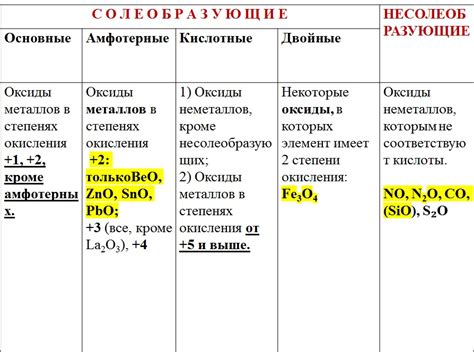
Оксиды металлов представляют собой химические соединения, состоящие из металла и кислорода. Их формулы определяются валентностью металла и его способностью соединяться с кислородом. В результате реакции металла с кислородом образуется оксид, который может иметь различные степени окисления.
Формулы оксидов металлов часто записываются с помощью химических обозначений элементов. Например, оксид алюминия обозначается как Al2O3, а оксид железа(II) – FeO. Здесь число после символа металла указывает на его степень окисления, а число после символа кислорода – на количество атомов кислорода в молекуле оксида.
Существует множество оксидов металлов, имеющих различные формулы. Примерами таких соединений являются оксиды меди(II) – CuO, цинка – ZnO, марганца(IV) – MnO2, свинца(II) – PbO и другие. Формулы оксидов металлов позволяют точно определить состав и свойства этих соединений, что важно для их применения в различных областях науки и промышленности.
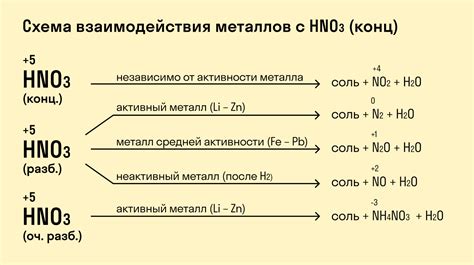
Реакции металлов с кислородом

Металлы - это вещества, обладающие высокой электропроводностью и способностью образовывать положительные ионы.
Реакции металлов с кислородом являются одной из основных химических реакций, которые происходят в природе и в лабораториях. В результате таких реакций образуются оксиды металлов, которые обладают различными свойствами и часто используются в промышленности и в повседневной жизни.
Оксиды металлов делятся на две основные группы: щелочные (основные) оксиды и кислотные (неметаллические) оксиды.
Щелочные оксиды являются основными веществами, они образуются при реакции металлов с кислородом. Примерами таких реакций являются:
- Образование оксида натрия: 4Na + O2 → 2Na2O
- Образование оксида калия: 4K + O2 → 2K2O
- Образование оксида магния: 2Mg + O2 → 2MgO
Кислотные оксиды, напротив, образуются при реакции неметаллов с кислородом. Примерами таких реакций могут служить:
- Образование оксида углерода: C + O2 → CO2
- Образование диоксида серы: 2S + O2 → 2SO2
- Образование оксида азота: 2N + O2 → 2NO
Таким образом, реакции металлов с кислородом являются важной частью химии и имеют применение в разных областях науки и промышленности. Изучение этих реакций позволяет лучше понять свойства и поведение металлов в различных условиях и использовать их эффективнее.
Образование оксидных пленок
Образование оксидных пленок является важным процессом, который происходит при взаимодействии металлов с кислородом. Когда металл контактирует с кислородом, происходит реакция окисления, в результате которой образуется оксид металла. Этот оксид образует тонкую пленку, называемую оксидной оболочкой, на поверхности металла.
Образование оксидных пленок играет важную роль в защите металлов от коррозии. Оксидные пленки обладают хорошей адгезией с поверхностью металла и образуют защитный барьер, который предотвращает проникновение кислорода и коррозионных веществ в металлическую структуру. Таким образом, оксидные пленки способствуют увеличению срока службы металлических изделий.
Величина толщины оксидной пленки зависит от многих факторов, включая тип металла, условия окисления и продолжительность процесса. Иногда оксидная пленка может быть очень тонкой и прозрачной, невидимой невооруженным глазом, в то время как в некоторых случаях она может быть толстой и иметь вид темного покрытия. В зависимости от типа металла, оксидные пленки могут иметь различные химические формулы, например, оксид железа Fe2O3 или оксид алюминия Al2O3.
Образование оксидных пленок может быть использовано и в других целях, кроме защиты от коррозии. Некоторые оксидные пленки обладают специальными свойствами, такими как проводимость или диэлектрическая проницаемость, и могут быть использованы в электронике или в других технологических приложениях. Например, оксид кремния SiO2 - один из наиболее распространенных оксидов, используемых в производстве микрочипов и солнечных панелей.
Коррозия металлов и ее связь с кислородом

Коррозия металлов – это процесс разрушения поверхности металла под воздействием окружающей среды. Главным веществом, которое способствует коррозии, является кислород. Взаимодействие металлов с кислородом приводит к образованию оксидов металла, которые являются главным признаком коррозии.
Воздействие кислорода на металлы приводит к окислению, при котором кислород вступает в реакцию с атомами металла и образует оксид. Например, железо при взаимодействии с кислородом образует оксид железа (Fe2O3).
Оксиды металлов, образующиеся при коррозии, имеют различные свойства и состояния. Некоторые из них обладают защитными свойствами и могут предотвращать дальнейшую коррозию, такие оксиды называют защитными пленками. Например, алюминий образует защитную оксидную пленку, которая предотвращает дальнейшую коррозию металла.
Однако, не все металлы обладают способностью образовывать защитные пленки. Некоторые металлы, например, железо, образуют оксиды, которые не защищают их от коррозии. Более того, оксиды железа могут образовывать пористые структуры, способствующие появлению коррозионных процессов.
Практическое применение оксидов металлов
Оксиды металлов, включая кислородные соединения, имеют широкое практическое применение в различных областях.
Одним из основных способов использования оксидов металлов является их применение в качестве катализаторов. Например, оксид меди (II) (CuO) используется в качестве катализатора при производстве водорода из воды или при окислении алканов. Оксид железа (Fe2O3) также применяется в катализаторах для различных процессов, включая аммиачную синтез.
Оксиды металлов широко используются также в производстве красителей и пигментов. Например, оксид железа (Fe2O3) используется для производства красного пигмента, известного как красный оксид железа. Оксид цинка (ZnO) применяется для производства белого пигмента.
Еще одним практическим применением оксидов металлов является их использование в процессах обжига и стеклотворения. Например, оксид свинца (PbO) добавляется в смесь при производстве стекла, чтобы улучшить его светопропускание и оптические свойства. Оксид алюминия (Al2O3) применяется при обжиге керамики для создания прочного и прочного материала.
Кроме того, многие оксиды металлов используются для производства электронных компонентов и полупроводников. Оксид кремния (SiO2) используется в производстве микроэлектронных чипов и полупроводниковых приборов. Оксид индия (In2O3) применяется в тонкопленочных транзисторах и плазменных экранах.
Вопрос-ответ

Какие металлы реагируют с кислородом?
Реагировать с кислородом могут различные металлы, такие как натрий, калий, кальций, магний, алюминий и др.
Какие химические формулы образуются при реакции металлов с кислородом?
При реакции металлов с кислородом образуются оксиды. Например, при реакции натрия с кислородом образуется оксид натрия (Na2O), а при реакции магния с кислородом образуется оксид магния (MgO).
Как происходит реакция металлов с кислородом?
При реакции металлов с кислородом происходит окисление металла. Металл отдает электроны кислороду и образует положительные ионы металла. В результате образуется оксид металла.
