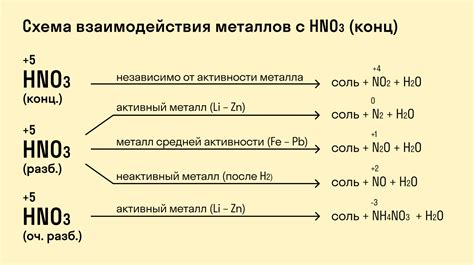
Азотная кислота, также известная как азотная кислота, - это хорошо известное химическое соединение, которое играет важную роль во многих процессах. В частности, она широко используется в химической промышленности и в лабораторных условиях. Азотная кислота реагирует с различными металлами, и процесс этой реакции может быть интересен и полезен для понимания свойств и характеристик этих металлов.
Одной из особенностей реакции металлов с азотной кислотой является их разная скорость и интенсивность. Некоторые металлы, такие как магний и цинк, реагируют с азотной кислотой очень быстро и агрессивно, с выделением большого количества газа и образованием пены. Другие металлы, такие как алюминий и железо, реагируют более медленно и спокойно. Это объясняется различием в их реакционной способности и химической активности.
Применение реакции металлов с азотной кислотой может быть разнообразным. Во-первых, это может быть использовано для определения наличия или отсутствия конкретного металла в пробе. Например, если происходит реакция с азотной кислотой только с одним металлом, то это может свидетельствовать о его присутствии. Во-вторых, реакция металлов с азотной кислотой может быть использована для очистки или обработки металлических поверхностей, таких как алюминий или сталь. Наконец, эта реакция также может иметь значение в области геологии и археологии, где ее можно применять для анализа и определения состава различных металлических прообразов.
Таким образом, изучение реакции различных металлов с азотной кислотой не только интересно с химической точки зрения, но и имеет практическое применение в различных областях. Это помогает нам лучше понять свойства и характеристики металлов, а также дать нам информацию о их содержании в разных образцах и соединениях. Наличие азотной кислоты открывает широкий спектр потенциальных применений, где реакция металлов может быть использована для достижения практических целей и научных исследований.
Влияние азотной кислоты на металлы: чего ожидать?

Азотная кислота – это сильная кислота, которая может реагировать с различными металлами. Ее воздействие на металлы может быть разнообразным и зависит от их химических свойств.
Один из наиболее распространенных эффектов взаимодействия азотной кислоты с металлами – это образование оксидов металлов. При этом образования оксидного слоя на поверхности металла происходит окисление металла и его превращение в более стабильное вещество.
Реакция эффекта азотной кислоты на металлы может протекать сообразно принципу реакции окисления-восстановления. Азотная кислота, как сильный окислитель, способна окислять металлы, переходя сама в восстановленное состояние. При этом металл обогащается кислородом, создавая оксидные продукты.
Влияние азотной кислоты на металлы может промежуточно включать образование нитратных соединений. Часто азотная кислота используется в промышленности для получения нитратов различных металлов, которые могут использоваться в производстве взрывчатых веществ, удобрений и прочих химических реактивов.
Азотная кислота и ее свойства

Азотная кислота (HNO3) является одной из наиболее распространенных и хорошо известных неорганических кислот. Она представляет собой безцветную или слегка желтоватую жидкость с характерным запахом и является очень реактивным веществом.
Основные свойства азотной кислоты:
- Кислотным характер – азотная кислота обладает сильными кислотными свойствами и может образовывать соли (нитраты) с щелочами и металлами.
- Окислительным действием – азотная кислота является мощным окислителем. Она способна окислять многие органические и неорганические вещества, в том числе металлы и их соединения.
- Высокой реактивностью – азотная кислота является очень реактивным веществом и может вызывать обильное выделение газов, взрывы и ожоги при неправильном обращении с ней.
- Способностью диссоциировать – при растворении в воде азотная кислота полностью диссоциирует на ионы H+ и NO3-, образуя кислотную среду.
Азотная кислота имеет широкое применение в различных областях, включая химическую промышленность, производство удобрений, электронику и аналитическую химию. Она используется для производства нитратов, радикалов и других химических соединений. Кроме того, азотная кислота может использоваться в качестве катализатора и окислителя в различных химических реакциях.
Самый распространенный металл: железо

Железо - самый распространенный металл на Земле, и его реакция с азотной кислотой имеет некоторые особенности. Под действием азотной кислоты железо может происходить коррозия металла, что приводит к образованию кислотных оксидов. Процесс коррозии железа сопровождается образованием отделяющегося газа - оксида азота. Коррозия железа является распространенным процессом при эксплуатации металлических конструкций и может привести к их разрушению.
Однако железо также может использоваться для получения азотных соединений. Например, при реакции железа с азотной кислотой может образовываться азотистый купорос, который широко применяется в сельском хозяйстве в качестве удобрения. Кроме того, железо может использоваться при производстве азотной кислоты в промышленных масштабах.
Важно отметить, что реакция железа с азотной кислотой может протекать лишь в определенных условиях, таких как наличие достаточного количества кислоты и наличие катализатора. Кроме того, реакция может протекать с различной интенсивностью в зависимости от концентрации азотной кислоты и температуры.
Хрупкий и реакционный: алюминий

Алюминий – один из самых распространенных металлов в земной коре. Он имеет серебристо-белый цвет и высокую электропроводность. Во многих отраслях промышленности алюминий используется широко, благодаря своим уникальным свойствам.
Алюминий является реакционным металлом, способным взаимодействовать с различными веществами. Одним из таких веществ является азотная кислота, с которой алюминий вступает в химическую реакцию.
Алюминий редко встречается в чистом виде в природе, так как он склонен быстро окисляться и образовывать покрытие оксида. Однако, благодаря своим реакционным свойствам, алюминий может быть использован в различных химических процессах.
Реакция алюминия с азотной кислотой протекает с образованием азота оксида и алюминиевого нитрата. Азот оксид может проявлять яркую окраску, что делает его полезным в качестве красителя. Алюминиевый нитрат используется в производстве красок, пигментов и смазок.
Алюминий – материал, который обладает низкой плотностью и высокой прочностью. Из-за своей простоты в обработке, алюминий широко используется в авиационной и автомобильной промышленности, а также в строительстве.
Стабильность в коррозии: нержавеющая сталь

Нержавеющая сталь - это специальный тип стали, который обладает уникальной способностью сопротивлять коррозии. Она представляет собой сплав железа, хрома и других элементов, таких как никель и молибден.
Основное преимущество нержавеющей стали заключается в том, что она, как правило, не ржавеет, не окисляется и хорошо справляется с воздействием различных химических веществ. Это делает ее идеальным материалом для использования в средах, где высокая устойчивость к коррозии является ключевым требованием.
Нержавеющая сталь широко используется в различных отраслях, таких как строительство, пищевая промышленность, химическая промышленность, медицина и многие другие. Она применяется для изготовления различных конструкций, трубопроводов, сосудов, оборудования и инструментов.
Важно отметить, что стабильность в коррозии нержавеющей стали достигается благодаря тонкой пленке оксида хрома, которая образуется на поверхности материала при взаимодействии с воздухом или водой. Эта пленка является защитным барьером, который предотвращает проникновение кислорода и других веществ во внутренние слои стали, что позволяет сохранить ее свойства на протяжении длительного времени.
Таинственные эффекты на цинк и медь

Реакция металлов с азотной кислотой – это интересное явление, при котором происходит химическое взаимодействие между азотной кислотой и металлами. Результат этой реакции для различных металлов может быть разным. В частности, цинк и медь проявляют таинственные эффекты.
Цинк реагирует с азотной кислотой, что приводит к образованию соединения цинка(II) нитрат. При этом наблюдается разложение кислоты с выделением газа и неприятным запахом. У интересно, что в результате реакции цинк становится черным, глянцевым и похожим на графит. Этот эффект обусловлен тем, что на поверхности цинка образуется тонкий слой чистого металла.
Медь, в свою очередь, тоже реагирует с азотной кислотой, но результат этой реакции имеет совершенно другой характер. Часть меди окисляется до двухвалентного состояния и образует соединение меди(II) нитрат. Остаточная медь образует на поверхности характерные купола, состоящие из коричневых кристаллических соединений меди и ее оксидов.
Таинственный эффект, наблюдаемый на цинке и меди в результате их взаимодействия с азотной кислотой, может быть объяснен разной реакцией металлов на окисление и разложение кислоты. Эти наблюдения можно использовать для различных практических целей, например, в аналитической химии или для создания эффектных экспериментов на уроках химии.
Практическое применение реакций металлов с азотной кислотой
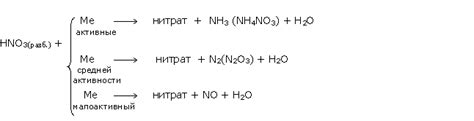
Реакции металлов с азотной кислотой находят широкое практическое применение в различных областях, включая промышленность, химическую исследовательскую лабораторную практику, а также в процессах препаративной химии.
Одним из наиболее распространенных применений реакций металлов с азотной кислотой является получение соединений для дальнейшего использования в различных отраслях промышленности. Например, реакция меди с азотной кислотой позволяет получить нитрат меди, который широко применяется в производстве удобрений, плотных взрывчатых веществ и керамических материалов.
Кроме того, реакции металлов с азотной кислотой используются в лабораторной практике для определения и идентификации различных металлов. Например, реакция железа с азотной кислотой приводит к образованию красновато-коричневого осадка, что является показателем наличия железа в образце.
Реакции металлов с азотной кислотой также применяются в процессах препаративной химии для получения органических соединений. Например, реакция цинка с азотной кислотой может быть использована для синтеза нитрозоных соединений, которые широко применяются в фармацевтической и агрохимической промышленности.
В целом, реакции металлов с азотной кислотой играют важную роль в сфере химии и промышленности, обеспечивая возможности для получения различных соединений, определения наличия металлов в образцах и создания новых органических веществ.
Вопрос-ответ

Какие металлы реагируют с азотной кислотой?
Реакция металлов с азотной кислотой происходит в зависимости от их активности. Например, реагируют такие металлы, как железо, цинк, алюминий, медь, никель и др.
Как происходит реакция металлов с азотной кислотой?
При взаимодействии металлов с азотной кислотой образуется соответствующий соль и выделяется диоксид азота и вода. Например, при реакции железа с азотной кислотой получается нитрат железа, диоксид азота и вода по следующему уравнению: 6HNO3 + 2Fe -> 2Fe(NO3)3 + 3H2O + 2NO2.
Какие особенности есть у реакции азотной кислоты с цинком?
При реакции цинка с азотной кислотой образуется нитрат цинка, диоксид азота и вода. Однако, особенностью данной реакции является то, что она происходит очень быстро и с выделением большого количества пузырьков газа. Это связано с тем, что цинк активный металл и быстро реагирует с азотной кислотой.
В чем применение реакции металлов с азотной кислотой?
Реакция металлов с азотной кислотой находит применение в различных областях. Например, нитраты, получаемые в результате данной реакции, используются в химической промышленности для производства удобрений. Кроме того, данная реакция может использоваться для анализа содержания металлов в различных образцах, так как в зависимости от металла, образующийся нитрат может иметь различную окраску, что упрощает его определение.