Азотная кислота, также известная как азотная или серная кислота, является одним из наиболее распространенных кислот в химии. Ее химическая формула HNO3 указывает на наличие атомов водорода, азота и кислорода, которые делают ее очень реакционноспособной и сильной.
Когда металлы вступают в контакт с азотной кислотой, возникают различные химические реакции. Во время этого взаимодействия происходит окисление металлов и образование нитратов. Нитраты, в свою очередь, обладают различными химическими и физическими свойствами, которые важны для многих научных и промышленных процессов.
Реакция металлов с азотной кислотой имеет практическое значение в различных областях, таких как производство удобрений, электроника и промышленное производство. Изучение этого взаимодействия позволяет узнать больше о свойствах металлов и их использовании в различных химических процессах.
В этой статье будут рассмотрены различные металлы и их реакция с азотной кислотой, а также рассмотрены химические задания и механизм взаимодействия. Это поможет лучше понять взаимодействие металлов с азотной кислотой и использовать эти знания в практике химических исследований и производства.
Реакция металлов с азотной кислотой: особенности взаимодействия

Реакция металлов с азотной кислотой является одной из важных химических реакций, которая происходит при контакте металла с азотной кислотой. Эта реакция характеризуется образованием соответствующих оксидов металлов и выделением газообразных продуктов.
Одной из наиболее известных особенностей реакции металлов с азотной кислотой является образование оксида азота(II) (диоксида азота). Этот оксид, который также называется "красная моль", образуется при реакции многих металлов с азотной кислотой. Оксид азота(II) имеет красный цвет и своеобразный запах.
При взаимодействии металлов с азотной кислотой обычно происходит выделение газообразного азота. Азот газа образуется при окислении азотных соединений, содержащихся в азотной кислоте, и является продуктом этой реакции. Выделение азота обычно сопровождается пузырьковым или шипящим звуком, что является характерным признаком происходящей реакции.
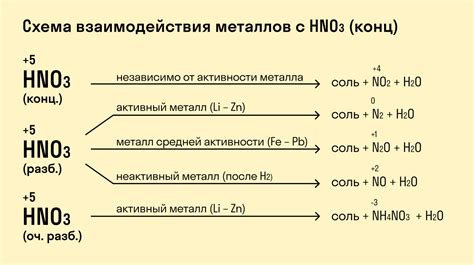
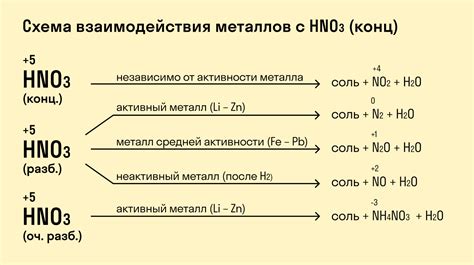
Также стоит отметить, что не все металлы активно реагируют с азотной кислотой. Цинк, железо, алюминий являются активными металлами, которые быстро вступают в реакцию с азотной кислотой. Однако драгоценные металлы, такие как золото и платина, не реагируют с азотной кислотой или реагируют очень медленно в силу своей низкой реактивности.
Азотная кислота: свойства и применение

Азотная кислота (HNO3) - химическое соединение, состоящее из атомов азота, кислорода и водорода. Она является одной из самых сильных кислот и обладает рядом характеристических свойств.
Одним из основных свойств азотной кислоты является ее высокая реакционная способность. Кислота способна разлагать множество органических и неорганических веществ, в том числе металлы. Взаимодействие азотной кислоты с металлами происходит с образованием соответствующих оксидов и выделением диоксида азота. К таким металлическим оксидам относятся оксид азота(II) (NO), оксид азота(IV) (N2O4) и оксид азота(V) (N2O5).
Применение азотной кислоты широко распространено в различных отраслях науки и промышленности. Она используется в химическом производстве для получения различных соединений азота, включая азотные удобрения, пластмассы и химические реактивы. Кроме того, азотная кислота применяется в процессах очистки металлов от загрязнений и в производстве взрывчатых веществ, таких как тротил.
Однако следует помнить, что азотная кислота является сильным окислителем и очень коррозивным веществом. Поэтому необходимо соблюдать меры предосторожности при работе с ней, такие как использование защитной одежды и очков, а также работа в хорошо проветриваемом помещении.
Химическое взаимодействие металлов с азотной кислотой
Азотная кислота (HNO3) является одним из наиболее распространенных химических соединений, используемых в лабораторной и промышленной практике. Кислотность этого соединения приводит к его реакции с различными металлами, что может иметь важные практические применения и потенциальные опасности.
При контакте с металлами, азотная кислота окисляет их, превращая саму себя в оксид азота и воду. Реакция может проходить с образованием пузырьков, выделением газов и/или изменением цвета раствора. В зависимости от условий реакции и самого металла, процесс может быть более или менее интенсивным.
Некоторые металлы, такие как медь и серебро, взаимодействуют с азотной кислотой с образованием характерных соляных соединений. Например, при реакции меди двухвалентный катион Cu2+ образует солянокислые соли, в то время как серебро дает образование серной кислоты AgNO3.
Реакция азотной кислоты с активными металлами, такими как натрий или калий, может протекать с ярким горением и расплавлением металла. Это связано с интенсивной реакцией между кислотой и металлом, в результате которой образуется нитрат металла и диоксид азота.
Однако, некоторые металлы, такие как золото и платина, не реагируют с азотной кислотой или реагируют очень медленно. Это связано с их высокой химической инертностью и устойчивостью к окислению. Такие свойства металлов могут быть использованы в различных областях, включая производство электроники и ювелирное дело.
Отбор металлов для реакции с азотной кислотой
Реакция металлов с азотной кислотой является одной из наиболее интересных и важных в химии. Для проведения этой реакции не все металлы подходят. Отбор металлов для реакции с азотной кислотой осуществляется на основе их активности и химических свойств.
Наиболее активные металлы, такие как калий, натрий и литий, могут активно реагировать с азотной кислотой. Они обладают высокой электроотрицательностью и способны образовывать стабильные и реакционноспособные соединения.
Металлы, относящиеся к серебру, меди, золоту и платине, не реагируют с азотной кислотой в обычных условиях. Эти металлы обладают низкой активностью и имеют высокую устойчивость к окислению.
Другая группа металлов, таких как железо, цинк, алюминий и олово, могут вступать в реакцию с азотной кислотой, но требуют повышенных температур или наличия катализатора для иницииации реакции.
Для иллюстрации применяются таблицы, в которых перечислены металлы и их активность по отношению к азотной кислоте. Обычно используются следующие обозначения: A - металл активный, P - металл пассивный, и R - металл реагирует с азотной кислотой только при повышенных температурах или с катализатором.
| Металл | Активность |
|---|---|
| Калий | A |
| Натрий | A |
| Литий | A |
| Железо | R |
| Цинк | R |
Таким образом, отбор металлов для реакции с азотной кислотой осуществляется на основе их активности и химических свойств. Учитывая активность металлов, можно предсказать их способность реагировать с азотной кислотой и использовать эту информацию при проведении химических экспериментов или производственных процессов.
Факторы, влияющие на скорость и интенсивность реакции

Реакция металлов с азотной кислотой является экзотермической и разлагает азотную кислоту на диоксид азота, азотную двуокись и воду. Скорость и интенсивность этой реакции зависят от нескольких факторов.
Первым фактором, который влияет на скорость и интенсивность реакции, является концентрация азотной кислоты. Чем выше её концентрация, тем больше количества активных частиц участвует в реакции, что ускоряет процесс и увеличивает интенсивность реакции.
Температура также оказывает влияние на скорость и интенсивность реакции. Повышение температуры приводит к увеличению средней скорости перемещения частиц и их энергии, что ускоряет столкновения и, соответственно, реакцию. В результате, скорость и интенсивность реакции металла с азотной кислотой возрастает.
Поверхность металла также может влиять на скорость реакции. Чем больше поверхность металла, тем больше активных центров для взаимодействия с азотной кислотой, что приводит к более быстрой реакции.
Наличие катализаторов может значительно повлиять на скорость и интенсивность реакции. Катализаторы ускоряют химическую реакцию, не изменяя свою структуру или расходуясь в процессе. Они снижают энергию активации, что способствует более быстрому перебору барьера и, следовательно, более быстрой реакции металла с азотной кислотой.
Таким образом, концентрация азотной кислоты, температура, поверхность металла и наличие катализаторов - все это факторы, которые влияют на скорость и интенсивность реакции металлов с азотной кислотой. Понимание этих факторов помогает контролировать условия реакции и оптимизировать её процесс.
Результаты реакции металлов с азотной кислотой
Металлы могут проявлять различные реакции при взаимодействии с азотной кислотой, в зависимости от их химических свойств.
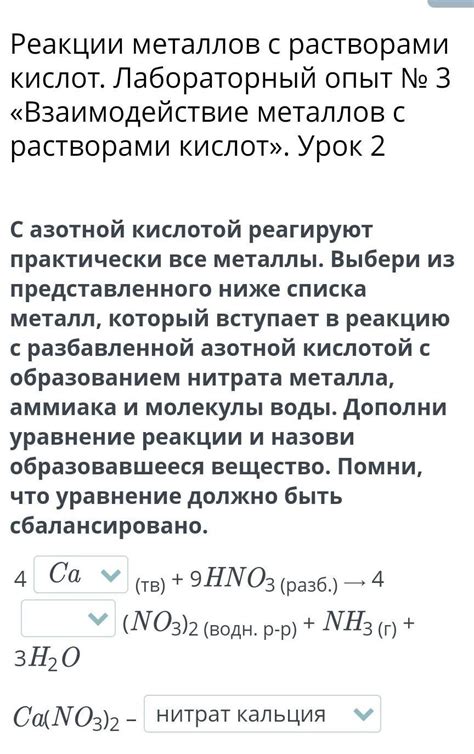
Некоторые металлы, такие как железо и алюминий, реагируют с азотной кислотой, образуя соответствующие соли и выделяя газы. Например, при взаимодействии железа с азотной кислотой образуется нитрат железа, Fe(NO3)2, и выделяется диоксид азота, NO2. Алюминий, в свою очередь, образует алюминиевый нитрат, Al(NO3)3, и выделяет оксид азота, NO.
Некоторые металлы, такие как цинк и свинец, не реагируют с азотной кислотой в нормальных условиях. Однако, при нагревании они могут вступать в реакцию с азотной кислотой, образуя нитраты соответствующих металлов и выделяя газообразные продукты.
Другие металлы, такие как медь и серебро, не реагируют с азотной кислотой и остаются неподвижными в ее присутствии.
Таким образом, результаты реакции металлов с азотной кислотой могут быть разнообразными и зависят от конкретных характеристик каждого металла.
Практическое применение реакции металлов с азотной кислотой

Реакция металлов с азотной кислотой имеет широкое практическое применение в различных областях, благодаря своим химическим свойствам и получаемым продуктам. Вот несколько примеров использования этой реакции:
- Синтез нитратов и азидов. Реакция металлов с азотной кислотой позволяет синтезировать различные нитраты и азиды, которые широко используются как компоненты взрывчатых веществ, пиротехнических смесей и ракетных топлив. Например, нитрат аммония (NH4NO3) используется в производстве удобрений и взрывчатых смесей.
- Очистка металлов. Азотная кислота может быть использована для очистки поверхности металлов от оксидных пленок и загрязнений. Реакция с азотной кислотой приводит к образованию нитратов, которые легко удаляются при последующей обработке поверхности металла.
- Химический анализ. Реакция металлов с азотной кислотой используется в химическом анализе для определения наличия металлов в различных образцах. В результате взаимодействия металлов с азотной кислотой образуются нитраты, которые можно обнаружить и проанализировать.
- Производство полимеров. Нитраты, получаемые в результате реакции металлов с азотной кислотой, могут быть использованы в процессе производства различных полимерных материалов, таких как пластмассы, резины и пенорезины. Нитраты служат в качестве катализаторов и добавок для улучшения качества и свойств этих материалов.
Таким образом, реакция металлов с азотной кислотой имеет широкий спектр практического применения и играет важную роль в различных областях, от промышленности до науки и исследований.
Вопрос-ответ

Какие металлы реагируют с азотной кислотой?
С азотной кислотой реагируют металлы активной группы реактивности, такие как медь, цинк, железо и алюминий.
Что происходит при реакции металлов с азотной кислотой?
При реакции металлов с азотной кислотой происходит окислительно-восстановительная реакция. Металл окисляется, а азотная кислота восстанавливается.
Какие продукты образуются при реакции меди с азотной кислотой?
При реакции меди с азотной кислотой образуются нитрат меди(II) и оксид азота(IV).
Как можно использовать реакцию металлов с азотной кислотой в промышленности?
Реакцию металлов с азотной кислотой можно использовать в промышленности для получения нитратов металлов, которые используются в качестве удобрений и сырья для производства различных химических соединений.
Можно ли использовать азотную кислоту для очистки поверхности металла от окислов и загрязнений?
Да, азотная кислота широко используется для очистки поверхности металлов от окислов и загрязнений. Она обладает высокой растворяющей способностью и способна удалять окислы с металлической поверхности, придавая ей блеск и чистоту.
