Металлическая реакция – это явление, которое происходит при взаимодействии различных металлов. Каждый металл имеет свои химические и физические свойства, которые определяют его поведение при реакции с другими металлами. Взаимодействие металлов может происходить различными способами, включая образование сплавов, окисление, образование комплексов или совместные реакции с другими веществами. Важно учитывать все эти факторы при изучении металлических реакций и их применении в различных областях, таких как металлургия, электроника и строительство.
Один из основных процессов, происходящих при металлических реакциях, - это образование сплавов. Когда два металла смешиваются, их атомы сливаются в одну структуру, образуя новый материал с уникальными свойствами. Сплавы широко используются в промышленности благодаря своим превосходным механическим и химическим характеристикам. Например, листы из алюминиевого сплава могут быть использованы для создания легких, прочных и долговечных конструкций.
Еще одной важной металлической реакцией является окисление. Многие металлы имеют способность реагировать с кислородом и образовывать оксиды. Окисление может способствовать образованию покрытия на поверхности металла, которое защищает его от дальнейшей коррозии. Некоторые металлы, такие как алюминий и цинк, обладают высокой степенью активности и быстро окисляются на воздухе. Другие металлы, такие как золото и платина, практически не реагируют с кислородом и сохраняют свою блестящую поверхность.
Не менее важными являются металлические реакции, которые происходят в присутствии других веществ. Металлы могут образовывать комплексы с различными органическими и неорганическими соединениями, что может влиять на их свойства и возможности использования. Например, железо может образовывать комплексы с кислыми или основными соединениями, что делает его полезным в медицине и промышленности.
Изучение металлических реакций - это важный аспект химии металлов, который позволяет лучше понять их химическую природу, реакционную способность и возможности применения в различных областях. Познакомившись с основными механизмами металлических реакций, мы сможем более эффективно использовать металлы для создания новых материалов, разработки новых технологий и улучшения качества жизни.
Металлическая реакция: свойства и особенности металлов взаимодействовать друг с другом

Металлы обладают уникальными свойствами, которые позволяют им взаимодействовать друг с другом и образовывать сплавы. Одним из основных свойств металлов является их способность проводить электрический ток. Это связано с наличием свободных электронов в их кристаллической структуре. Когда два металла контактируют между собой, электроны переносятся от одного металла к другому, образуя электрическую цепь.
Взаимодействие металлов друг с другом также связано с их химической реакционной способностью. Некоторые металлы обладают большей активностью и способны с легкостью образовывать химические соединения с другими металлами. Например, калий и натрий могут реагировать с большинством металлов, образуя соли. Такие реакции основаны на обмене ионами и происходят под воздействием теплоты или электрического тока.
Однако не все металлы взаимодействуют друг с другом равнозначно. Взаимодействие зависит от электрохимического потенциала металлов, который характеризует их способность образовывать положительные и отрицательные ионы. Металлы с более высоким электрохимическим потенциалом будут иметь большую активность и могут вытеснять металлы с более низким потенциалом из их соединений.
Взаимодействие металлов может быть столь интенсивным, что приводит к коррозии и разрушению. Таким образом, при соприкосновении металлов важно учитывать их химическую совместимость и предпринимать необходимые меры для предотвращения нежелательных реакций, например, покрытием металлов защитным слоем или использованием изолирующих материалов.
Металлы и их реактивность

Металлы обладают разной степенью реактивности, которая определяется их способностью вступать в химические реакции. Реактивность металлов может быть разной из-за различий в их электрохимическом потенциале и способности отдавать или принимать электроны.
Наиболее реактивными металлами являются щелочные и щелочноземельные металлы, такие как литий, натрий, калий, магний и кальций. Они легко реагируют с кислородом, водой и кислотами, выделяя водород. Эти металлы имеют низкий электрохимический потенциал, что позволяет им легко отдавать электроны и образовывать положительные ионы в реакциях.
Другие металлы, такие как железо, цинк и алюминий, являются менее реактивными по сравнению с щелочными металлами. Они могут реагировать с кислотами, но не с водой. Например, железо реагирует с кислородом, образуя ржавчину, а цинк реагирует с кислотой с выделением водорода.
Некоторые металлы, такие как серебро и золото, являются малореактивными и не реагируют с кислородом или водой. Они обладают высоким электрохимическим потенциалом и малой способностью отдавать электроны.
Таким образом, реактивность металлов зависит от их электрохимического потенциала и способности вступать в реакции с другими веществами. Знание о реактивности металлов позволяет прогнозировать и контролировать процессы, связанные с их использованием в промышленности и повседневной жизни.
Химические реакции между металлами
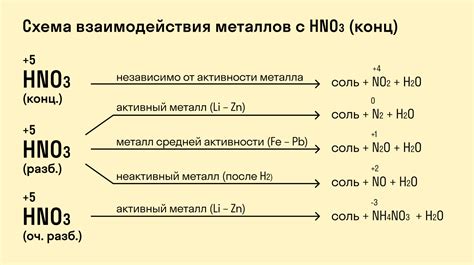
Металлы обладают уникальными свойствами и способны взаимодействовать друг с другом, образуя различные химические соединения. Такие реакции являются важным объектом изучения в химии и имеют широкое применение в промышленности и научных исследованиях.
Одним из наиболее распространенных типов химических реакций между металлами является образование сплавов. Сплавы обладают уникальными физическими и химическими свойствами, которые отличаются от свойств исходных металлов. При этом в процессе образования сплава между металлами происходят различные химические реакции, в результате которых образуются новые химические соединения.
Некоторые сплавы обладают повышенной прочностью, твердостью или устойчивостью к коррозии, что делает их незаменимыми материалами во многих отраслях промышленности, таких как машиностроение, авиация, электроника. Кроме того, химические реакции между металлами могут использоваться для получения различных материалов с желаемыми свойствами, например, сплавов с регулируемыми магнитными или электрическими характеристиками.
Другим примером химических реакций между металлами является образование гальванических пар. Гальваническая пара представляет собой систему, в которой два металла контактируют в электролите и происходит перенос электронов между ними. В результате этого процесса один металл окисляется, а другой восстанавливается. Гальванические пары используются в различных электрохимических системах, таких как аккумуляторы или гальванические элементы.
Окислительно-восстановительные реакции металлов

Окислительно-восстановительные реакции металлов представляют собой химические превращения, при которых происходит перенос электронов между металлами. В таких реакциях один металл окисляется, теряя электроны, другой металл восстанавливается, приобретая электроны.
Окислительно-восстановительные реакции металлов широко используются в различных областях, включая производство металлургических материалов, электрохимические процессы и энергетику. В этих реакциях могут участвовать как один металл, так и несколько металлов одновременно.
Важным параметром в окислительно-восстановительных реакциях металлов является электродный потенциал металла. Он характеризует способность металла отдавать или получать электроны. Металлы с более высоким электродным потенциалом обладают большей способностью к окислению, то есть отдаче электронов, в то время как металлы с более низким электродным потенциалом легче восстанавливаются, то есть получают электроны.
Примером окислительно-восстановительной реакции металлов может быть реакция между железом и медью. В данной реакции участвуют два металла: железо и медь. Железо оказывается более активным металлом и окисляется, при этом теряя электроны. Медь, в свою очередь, восстанавливается, приобретая эти электроны.
Ионные реакции между металлами
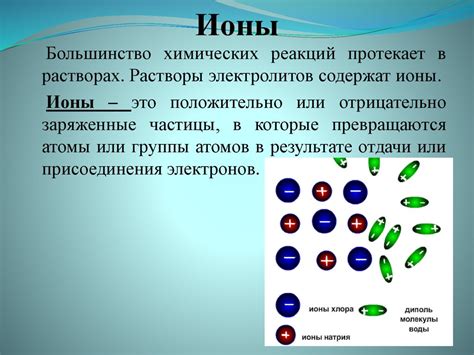
Ионные реакции между металлами - это процессы взаимодействия ионов двух разных металлов, которые приводят к образованию новых соединений. В таких реакциях ионы металлов обмениваются, что приводит к изменению зарядов и образованию ионных соединений.
При ионных реакциях между металлами происходит передача электронов от одного металла к другому. Общий принцип таких реакций заключается в том, что металл с более низким электроотрицательностью отдает электроны металлу с более высокой электроотрицательностью.
Ионные реакции между металлами могут протекать только в том случае, если образующееся ионное соединение более устойчиво, чем исходные металлы. Это связано с тем, что при реакции ионы металлов стараются образовать состояние максимальной стабильности и минимальной энергии.
Примером ионной реакции между металлами может служить реакция между цинком (Zn) и медью (Cu). При этой реакции цинк отдает два электрона меди, образуя ион Zn2+, а медь принимает эти электроны, образуя ион Cu2+. Таким образом, образуются ионы Zn2+ и Cu2+ и образуется новое ионное соединение - цинковая соль и медь.
Взаимодействие сплавов и смесей металлов

Взаимодействие сплавов и смесей металлов представляет собой сложный процесс, который зависит от состава и структуры материала, а также от условий окружающей среды. Такие взаимодействия могут приводить к различным физическим и химическим превращениям, важными из которых являются образование соединений, растворение, аморфизация и ордеринг.
Одним из главных факторов, влияющих на взаимодействие металлов, является их электрохимический потенциал. Металлы с более высоким электрохимическим потенциалом обычно будут взаимодействовать с металлами с более низким потенциалом, что может привести к коррозии и образованию гальванических пар.
Сплавы, состоящие из нескольких металлов, обладают особыми свойствами, которые отличают их от чистых металлов. Взаимодействие компонентов сплава может привести к образованию новых фаз и изменению структуры, что влияет на его механические и химические свойства.
- При взаимодействии сплавов может происходить образование интерметаллических соединений, которые обладают новыми свойствами и обуславливают технологические и эксплуатационные характеристики материала.
- Смеси металлов могут демонстрировать различные эффекты, такие как синергетическое взаимодействие, когда свойства сплава превышают сумму свойств компонентов.
- Взаимодействие металлов может приводить к изменению структуры системы и образованию дисперсных фаз, что, в свою очередь, влияет на механические и физические свойства сплава.
В зависимости от условий эксплуатации и состава сплава или смеси металлов, взаимодействие материалов может быть полезным или нежелательным. Изучение этих процессов помогает разрабатывать новые материалы с определенными свойствами и улучшать их производственные и эксплуатационные характеристики.
Вопрос-ответ

Как происходит металлическая реакция?
Металлическая реакция происходит путем взаимодействия двух или более металлов. В результате этого взаимодействия образуются новые соединения или сплавы. Металлы могут реагировать друг с другом путем обмена ионами или электронами. Обмен ионами осуществляется в том случае, если металлы находятся в водных растворах или плавятся. В случае обмена электронами происходит передача электронов от одного металла к другому.
Какие факторы влияют на скорость металлической реакции?
На скорость металлической реакции влияют несколько факторов. Во-первых, концентрация реагентов - чем выше концентрация металлов, тем быстрее будет протекать реакция. Во-вторых, температура - при повышении температуры скорость реакции также увеличивается, поскольку повышается активность металлов. Также влияет наличие катализаторов - веществ, которые способствуют увеличению скорости реакции. Другим фактором является площадь поверхности металлов - чем больше площадь контакта металлов, тем быстрее будет протекать реакция.
