Металлы главных подгрупп представляют большой интерес из-за их реакции с окружающей средой и другими веществами. В особых условиях они способны выделять водород, изменять свойства и даже взаимодействовать с другими металлами. Особый интерес вызывает их взаимодействие при комнатной температуре, так как именно при таких условиях происходит большинство процессов в повседневной жизни.
Взаимодействие всех металлов главных подгрупп в основном определяется их атомным строением и химическими свойствами. Некоторые металлы могут образовывать сплавы, в которых их атомы сливаются в единое целое. Такие сплавы способны проявлять уникальные свойства, которые отличаются от свойств отдельных металлов. Взаимодействие сплавов с другими металлами может приводить как к образованию стабильных соединений, так и к химическим реакциям с выделением различных продуктов.
Охлаждение и нагревание металлов главных подгрупп при комнатной температуре может вызывать их сильное деформирование и изменение свойств. В некоторых случаях, при взаимодействии различных металлов, происходит обмениваться электронами и возможно образование электрических потенциалов, что может привести к химическим реакциям.
Металлы первой главной подгруппы

Металлы первой главной подгруппы характеризуются тем, что они встречаются в природе в виде окислов или сульфидов. Они активны и легко вступают в химические реакции. Основным представителем этой главной подгруппы является литий. Этот металл обладает низкой плотностью и является самым легким из всех металлов. Литий обладает высокой электроотрицательностью и под воздействием воздуха быстро окисляется.
Вторым представителем первой главной подгруппы является натрий. Натрий является более распространенным, чем литий, и широко используется в промышленности. Он встречается в природе в виде минералов, таких как галька и шпат.
Калий также относится к металлам первой главной подгруппы. Калий является непрозрачным серебристо-белым металлом, который легко реагирует с водой. Он также используется в промышленности и сельском хозяйстве.
Рубидий и цезий являются менее распространенными металлами первой главной подгруппы. Они имеют свойства, схожие с свойствами лития, натрия и калия, но более реактивны. Эти металлы также используются в научных исследованиях и различных технических процессах.
Металлы щелочных и щелочноземельных металлов

Металлы щелочных и щелочноземельных металлов являются важной категорией металлов главных подгрупп и обладают рядом уникальных свойств.
Металлы щелочных металлов, такие как литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr), характеризуются низкой плотностью и низкой температурой плавления. Они очень реактивны и мягкие, их можно легко резать ножом. Благодаря этим свойствам, металлы щелочных металлов широко используются в различных областях, включая производство батареек, сплавов и лекарств.
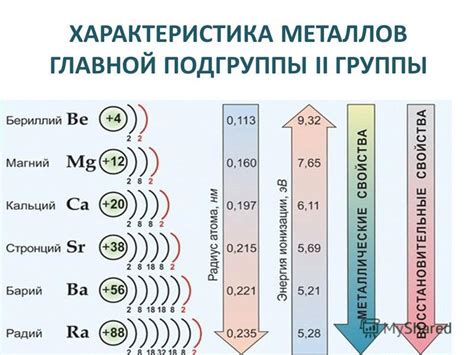
Металлы щелочноземельных металлов, такие как бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra), также обладают интересными свойствами. Они более плотные и твердые по сравнению с щелочными металлами, но все равно обладают низкой плотностью и низкой температурой плавления. Щелочноземельные металлы также обладают высокой степенью реактивности и являются важными компонентами сплавов и материалов для строительства. Они также применяются в различных промышленных процессах и в производстве огнетушителей.
Металлы щелочных и щелочноземельных металлов имеют ряд сходных свойств, таких как высокая электропроводность, способность образовывать ионы с положительным зарядом и реактивность с водой. Они также обладают способностью образовывать стабильные соединения с другими элементами в таблице Менделеева. Все эти свойства делают металлы щелочных и щелочноземельных металлов важными и полезными в различных областях науки и промышленности.
Металлы алюминия и галлия

Алюминий - это легкий, прочный и коррозионностойкий металл, который обладает высокой электропроводимостью. Он является третьим по распространенности элементом на Земле и находится во множестве различных природных минералов. Алюминий используется в различных отраслях, включая авиацию, строительство, упаковку и электронику.
Галлий - это мягкий, сравнительно низкоплавкий и коррозионностойкий металл. Он имеет широкий спектр применения в электронике, фотонике и оптике благодаря своим полупроводниковым свойствам. Галлий также используется в современных технологиях, включая солнечные батареи, светодиоды и радиоэлектронику.
Оба металла, алюминий и галлий, являются членами третьей главной подгруппы периодической системы элементов и обладают сходными свойствами. Они оба относятся к легким металлам и обладают высокой электропроводимостью. Однако галлий имеет более низкую температуру плавления по сравнению с алюминием, что делает его особенно полезным в некоторых специализированных областях, где требуется применение материалов с низкой температурой плавления.
- Важно отметить, что алюминий и галлий могут образовывать сплавы с другими металлами, что расширяет их применение и свойства.
- Также стоит отметить, что алюминий и галлий являются основными материалами в некоторых передовых технологиях, таких как производство полупроводников и нанотехнологии.
В целом, металлы алюминия и галлия играют важную роль в различных отраслях промышленности и науки благодаря своим уникальным свойствам и возможностям.
Металлы второй главной подгруппы
Металлы второй главной подгруппы, также известные как переходные металлы, обладают уникальными свойствами и широким спектром применения. Эти металлы включают в себя элементы, такие как титан (Ti), ванадий (V), хром (Cr), марганец (Mn), железо (Fe), кобальт (Co), никель (Ni) и медь (Cu).
Металлы второй главной подгруппы обладают высокой термической и электрической проводимостью, а также хорошей пластичностью и прочностью. Они также обладают способностью образовывать разнообразные сплавы, что делает их неотъемлемой частью металлургической и авиационной промышленности.
Каждый из металлов второй главной подгруппы имеет свои особенности и применения. Например, титан применяется в производстве легких и прочных сплавов, используемых в авиастроении и медицине. Ванадий используется в производстве сплавов, улучшающих прочность и термическую стойкость стали. Хром применяется для придания прочности и непроницаемости стали, а также для создания декоративных покрытий.
Металлы второй главной подгруппы играют важную роль в различных отраслях промышленности и технологии. Их уникальные свойства делают их необходимыми компонентами в производстве автомобилей, самолетов, медицинского оборудования и других изделий, требующих прочности, стойкости к коррозии и высокой термостойкости.
Металлы цинка и кадмия

Металл цинк (Zn) является главным элементом IV-й группы периодической системы. Он имеет серый цвет и характерный блеск. Цинк обладает хорошей коррозионной стойкостью и широко используется в промышленности, особенно в производстве цинкового покрытия, легирования стали, производства аккумуляторов и других изделий.
Кадмий (Cd) также относится к IV-й группе периодической системы, однако он имеет меньшую популярность по сравнению с цинком. Кадмий обладает серебристо-белым цветом и отличается высокой пластичностью. Его главное применение в промышленности связано с производством аккумуляторов на основе никель-кадмиевых элементов, а также с использованием кадмиевых соединений в производстве красителей, пигментов и стеклопродукции.
Оба металла обладают высокой химической активностью и способны реагировать с кислородом и различными кислотами. Они имеют отличные электропроводные свойства и используются в электротехнике и электронике. Кроме того, цинк и кадмий обладают антикоррозионными свойствами и широко применяются в гальваническом производстве, где служат защитным покрытием для других металлов.
Вопрос-ответ

Какие металлы взаимодействуют между собой при комнатной температуре?
При комнатной температуре большинство металлов не взаимодействуют между собой. Однако некоторые металлы могут образовывать сплавы, такие как бронза (медь и олово) или латунь (медь и цинк).
Почему не все металлы образуют сплавы при комнатной температуре?
Образование сплавов зависит от структуры и химических свойств каждого металла. Некоторые металлы имеют схожую структуру и электронную конфигурацию, что позволяет им образовывать сплавы. Другие металлы имеют совершенно различные химические свойства и не способны образовывать сплавы.
Какие металлы являются наиболее реактивными и способны взаимодействовать при комнатной температуре?
Наиболее реактивными металлами при комнатной температуре являются щелочные металлы, такие как литий (Li), натрий (Na) и калий (K). Они могут реагировать с водой и воздухом, образуя разнообразные соединения.
