Металлы главной подгруппы 2 группы химических элементов в периодической системе Менделеева известны своей реакционной способностью с водой. Данные металлы включают в себя бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr) и барий (Ba). Их взаимодействие с водой имеет свои особенности и может проявляться через различные химические реакции.
Одной из характерных особенностей металлов главной подгруппы 2 группы является их способность реагировать с водой только при нагревании или при наличии катализаторов. Например, магний образует оксид магния (MgO) и водород (H2) при взаимодействии с горячей водой или паром. Кальций, в свою очередь, образует оксид кальция (CaO) и водород при нагревании с водой.
Кроме того, металлы главной подгруппы 2 группы могут образовывать гидроксиды при контакте с водой. Например, реакция бериллия с водой приводит к образованию гидроксида бериллия (Be(OH)2). Этот гидроксид обладает амфотерными свойствами и может образовывать соли с различными кислотами и гидроксидами.
Таким образом, взаимодействие металлов главной подгруппы 2 группы с водой обусловлено их реакционной способностью и может проявляться через образование оксидов, водорода и гидроксидов. Изучение данных реакций позволяет получить новые соединения и расширить наши знания о химических свойствах данных элементов.
История и значения металлов главной подгруппы 2 группы
Металлы главной подгруппы 2 группы включают в себя магний, цинк, кадмий и ртуть.
Магний, первый элемент главной подгруппы 2 группы, был открыт в 1755 году шведским химиком Й.Г. Ганном. Он является легким металлом с серебристо-белым оттенком и высокой пластичностью. Магний имеет широкое применение в промышленности: от изготовления авиационных компонентов до производства сплавов и батареек.
Цинк, второй элемент главной подгруппы 2 группы, был использован в древнем Египте и Риме для производства легких и прочных сплавов. Сегодня цинк широко используется в гальванической и строительной промышленности, а также в производстве батарей и лекарственных препаратов.
Кадмий, третий элемент главной подгруппы 2 группы, был открыт в 1817 году германским химиком Фридрихом Штромейером. Он является токсичным металлом, который использовался в прошлом в качестве пигмента и покрытия для металлических изделий. Сейчас кадмий применяется в производстве аккумуляторов, фотоэлементов и гальванических покрытий.
Ртуть, последний элемент главной подгруппы 2 группы, известна с древних времен. Она была использована в качестве косметического средства и ядовитого агента. Сегодня ртуть используется в различных промышленных процессах, включая изготовление электрических приборов и зеркал.
Физические и химические свойства металлов главной подгруппы 2 группы
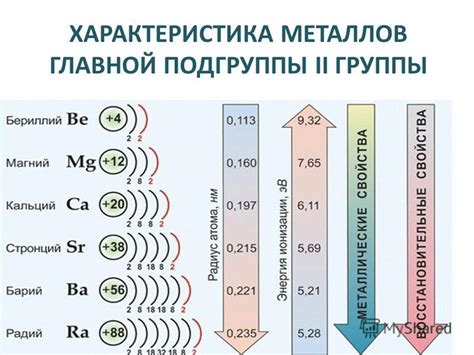
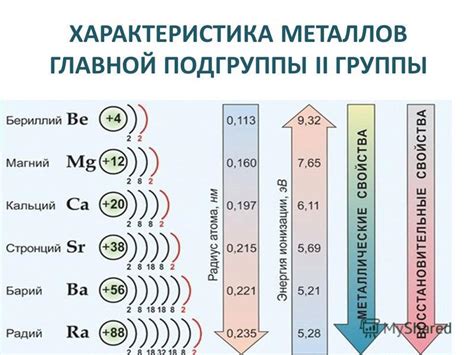
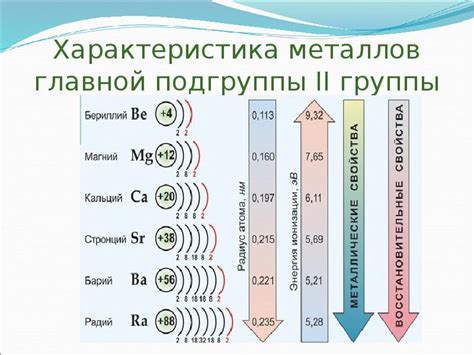
Металлы главной подгруппы 2 группы - это химические элементы, которые расположены в таблице Менделеева во 2 строке, начиная с бериллия и заканчивая барием. Эти металлы обладают рядом общих физических и химических свойств, которые делают их уникальными и полезными в различных областях промышленности и науки.
Физические свойства металлов главной подгруппы 2 группы включают высокую тепло- и электропроводность, хорошую пластичность и формовку, а также высокую плотность и твердость. Например, бериллий является одним из самых легких и жестких металлов, а барий - одним из самых плотных. Эти свойства позволяют использовать металлы данной группы в производстве легких и прочных конструкций, электронных устройств и термических материалов.
Химические свойства металлов главной подгруппы 2 группы включают высокую реактивность с кислородом и водой. Например, бериллий реагирует с водой, образуя гидроксид бериллия и выделяя водород. Кальций реагирует с кислородом и водой, образуя соответственно оксиды и гидроксиды. Эти реакции могут быть использованы для получения соответствующих соединений и водорода, а также для синтеза различных металлических материалов и соединений.
- Бериллий (Be) - легкий, жесткий, обладает химической инертностью и высокой теплопроводностью.
- Магний (Mg) - легкий, конструкционный, обладает высокой прочностью и стойкостью к коррозии.
- Кальций (Ca) - реактивный, образует оксиды и гидроксиды при взаимодействии с кислородом и водой.
- Стронций (Sr) - мягкий, термоэлектрический, используется в производстве светящихся покрытий.
- Барий (Ba) - плотный, является хорошим поглотителем рентгеновского излучения.
Использование металлов главной подгруппы 2 группы в различных отраслях промышленности и науки обусловлено их уникальными физическими и химическими свойствами. Эти металлы являются неотъемлемой частью современных технологий и имеют широкий спектр применений в производстве электроники, авиации, строительства и других отраслях.
Процессы окисления металлов главной подгруппы 2 группы
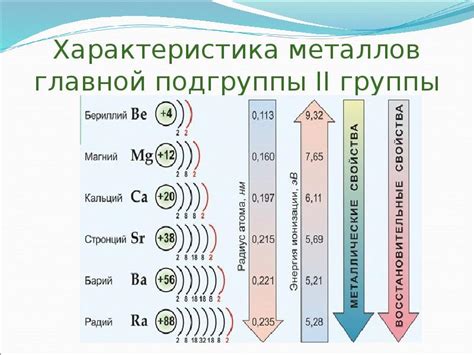
Металлы главной подгруппы 2 группы периодической системы - бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra) - обладают способностью активно взаимодействовать с водой и подвергаться процессам окисления.
Первым металлом подгруппы является бериллий. Он обладает высокой химической стойкостью и практически не взаимодействует с водой. Магний и другие металлы главной подгруппы 2 группы взаимодействуют с водой при нагревании или при наличии катализаторов.
Вода реагирует с металлами главной подгруппы 2 группы, образуя гидроксид и выделяя гидроген. Например, магний при взаимодействии с водой образует гидроксид магния (Mg(OH)2) и освобождает гидрогенный газ. Такая реакция протекает с выделением большого количества тепла.
Реактивность металлов главной подгруппы 2 группы с водой возрастает по мере увеличения атомного номера. Например, бериллий практически не взаимодействует с водой, а радий реагирует с ней очень интенсивно.
Взаимодействие металлов главной подгруппы 2 группы с водой является одним из способов получения гидроксидов этих металлов, которые широко используются в различных отраслях промышленности и научных исследованиях.
Взаимодействие металлов главной подгруппы 2 группы с водой: причины и реакции
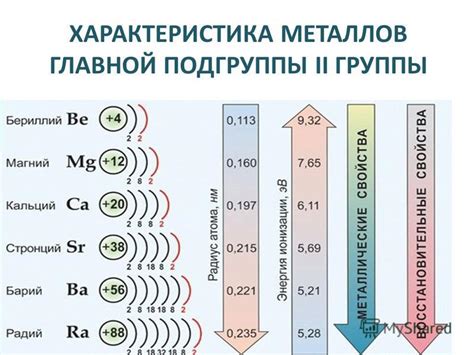
Металлы главной подгруппы 2 группы периодической системы, такие как магний, цинк и кадмий, характеризуются особым взаимодействием с водой. Одной из причин такого взаимодействия является их свойство образовывать гидроксиды, в результате чего происходит реакция образования новых веществ и выделение газа.
Например, магний реагирует с водой, образуя гидроксид магния и высвобождая водород. Эта реакция может быть представлена следующим уравнением:
Магний + Вода → Гидроксид магния + Водород
Также цинк образует гидроксид цинка и выделяет водород при взаимодействии с водой:
Цинк + Вода → Гидроксид цинка + Водород
Кадмий, в свою очередь, образует гидроксид кадмия и выделяет газ:
Кадмий + Вода → Гидроксид кадмия + Водород
Такие реакции характерны для металлов главной подгруппы 2 группы и происходят в результате активного протекания электрохимических процессов во время взаимодействия с водой. Важно отметить, что данные металлы реагируют с водой только при наличии активной поверхности, так как образуется пленка оксида или гидроксида на поверхности металла. Эта пленка защищает металл от дальнейшего взаимодействия с водой.
Практическое применение и области применения металлов главной подгруппы 2 группы
Металлы главной подгруппы 2 группы (магний, цинк, кальций, стронций и барий) имеют широкое практическое применение в различных отраслях промышленности и научных исследованиях. Они обладают рядом полезных свойств, таких как высокая прочность, устойчивость к коррозии и хорошая проводимость электрического тока.
Магний широко используется в авиационной и автомобильной промышленности из-за своей легкости, прочности и способности поглощать энергию при ударе. Он используется для производства легких сплавов, которые применяются в строительстве самолетов, автомобилей и велосипедов. Магний также используется в производстве фармацевтических препаратов, пищевых добавок и взрывчатых веществ.
Цинк широко применяется в производстве оправок для стекла, каркасов для строительства, а также в атомной энергетике и военной промышленности. Цинк используется в виде покрытий для защиты металлов от коррозии, таких как стальные конструкции и автомобильные кузова. Он также используется в производстве батарей, косметики и лекарств.
Кальций используется в качестве сплавов с другими металлами для повышения их прочности. Он также используется в производстве алюминия, меди, железа и других металлов. Кальций применяется в литейной промышленности, в процессе очистки стали и в производстве цемента. Кальций также является важным минералом для здоровья человека, он необходим для крепления костей и функционирования нервной системы.
Стронций используется в производстве магнитов, керамики и ядерного топлива. Стронций-90, радиоактивный изотоп стронция, используется в медицине для радиотерапии. Стронций также используется в производстве свечей и красителей.
Барий используется в производстве сплавов, алюминия и стали. Барий-сульфат используется в медицине для рентгенологического исследования желудочно-кишечного тракта. Барий также используется в производстве стекла, красителей, пиротехнических составов и рентгеновских экранов.
Перспективные исследования в области взаимодействия металлов главной подгруппы 2 группы с водой

Взаимодействие металлов главной подгруппы 2 группы с водой представляет большой интерес для научных исследований. Одним из перспективных направлений в этой области является изучение кинетики и термодинамики процессов реакции металлов с водой. При этом особое внимание уделяется реакциям образования оксидов и гидроксидов металлов, а также исследованию возможности получения водорода при взаимодействии металлов с водой.
Другим перспективным направлением исследований является анализ влияния различных факторов на взаимодействие металлов главной подгруппы 2 группы с водой. В частности, исследуются температурные условия, концентрация реагирующих веществ, присутствие катализаторов и наличие дополнительных реагентов. Это позволяет выявить влияние различных параметров на скорость реакции и получить более полное представление о механизме взаимодействия металлов с водой.
Также отдельно исследуется взаимодействие металлов главной подгруппы 2 группы с водой в особых условиях, например, при повышенном давлении или в присутствии других растворителей. Это позволяет расширить возможности использования таких реакций в различных технологических процессах, включая производство водорода, очистку воды и получение других полезных продуктов.
Таким образом, исследования в области взаимодействия металлов главной подгруппы 2 группы с водой имеют большой потенциал для развития новых технологий и процессов. Они позволяют расширить наше понимание о свойствах и возможностях этих металлов и создать новые подходы к их применению в различных сферах науки и промышленности.
Вопрос-ответ

Каково взаимодействие металлов главной подгруппы 2 группы с водой?
Взаимодействие металлов главной подгруппы 2 группы с водой происходит с образованием оснований и выделением водорода.
Какие металлы относятся к главной подгруппе 2 группы?
К главной подгруппе 2 группы относятся металлы бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Какие особенности есть во взаимодействии металлов главной подгруппы 2 группы с водой?
Особенности взаимодействия металлов главной подгруппы 2 группы с водой включают образование щелочных оснований и выделение водорода. Кроме того, металлы главной подгруппы 2 группы реагируют с водой медленнее, чем металлы главной подгруппы 1 группы.
Какие реакции происходят при взаимодействии металлов главной подгруппы 2 группы с водой?
При взаимодействии металлов главной подгруппы 2 группы с водой образуется соответствующее основание в виде гидроксида металла и выделяется водород. Например, магний реагирует с водой, образуя гидроксид магния (Mg(OH)2) и выделяя водород (H2).
