Взаимодействие металла с солью - это процесс, в ходе которого происходит реакция между металлом и химическим соединением соли. Такое взаимодействие может иметь различные формы и вызывать разнообразные изменения в структуре и свойствах обоих веществ.
Одной из наиболее распространенных реакций между металлом и солью является окислительно-восстановительная реакция. В этом случае металл выступает в роли среды, способной окислять атомы других веществ, в то время как соль действует в качестве вещества, подвергающегося окислению. В результате такой реакции металл может изменить свою окраску, структуру или физические свойства.
Некоторые металлы имеют большую аффинность к соли, что означает, что они более активны в реакции с ней. Например, реакция между натрием и хлоридом натрия приводит к образованию поваренной соли - хлорида натрия. В этом случае натрий окисляется, а хлорид натрия восстанавливается.
Интересно отметить, что реакция металла на соль может протекать не только в твердой, но и в жидкой или газообразной фазе. Например, в ходе электролиза раствора медного(II) сульфата медный металл осаждается на отрицательном электроде, тогда как серная кислота восстанавливается.
В общем, взаимодействие металла с солью представляет собой сложный процесс, в результате которого происходят окислительно-восстановительные реакции, изменения структуры и свойств веществ. Изучение этих реакций позволяет более полно понять их сущность и применять полученные знания в различных областях науки и промышленности.
Процесс окисления металла при контакте с солью
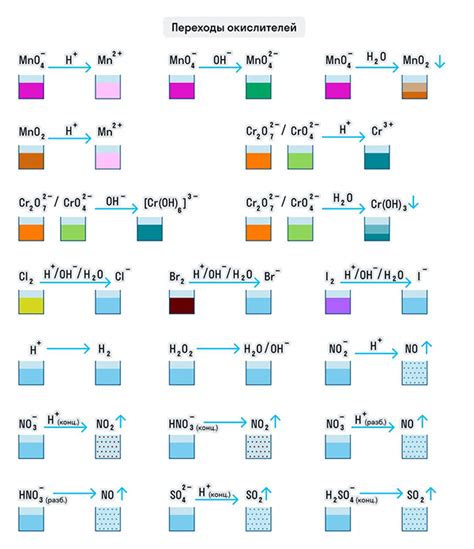
Окисление металла при контакте с солью является химической реакцией, в результате которой металл переходит в окисленное состояние. Данное явление происходит из-за того, что соль содержит ионы, которые способны образовывать окислительно-восстановительные реакции с металлом.
Когда металл контактирует с солью, ионы соли вступают в взаимодействие с поверхностью металла. При этом происходит окисление металла, то есть передача электронов от металла к ионам соли. Это может привести к образованию оксидов и солей металла в результате поглощения кислорода из воздуха.
Реакция окисления металла при контакте с солью может протекать с различной интенсивностью, в зависимости от типа металла и соли. Некоторые металлы, такие как железо или алюминий, склонны к более быстрой окислительной реакции с разными видами солей. Другие металлы, например платина или золото, окисляются гораздо медленнее и могут сохранять свою блеск при контакте с солями.
Контакт металла с солью может вызывать различные последствия, такие как коррозия, образование осадков или изменение свойств металла. Окисление металла может привести к образованию защитной пленки на его поверхности, которая предотвращает дальнейшую коррозию и сохраняет прочность и эстетический вид металла.
Влияние электролитов на поверхность металла
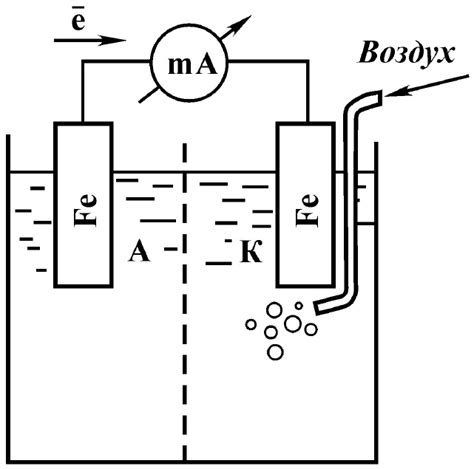
Электролиты, такие как соли, оказывают влияние на поверхность металла в ходе процесса взаимодействия. Эта реакция происходит в результате перемещения электрических зарядов между электролитом и металлической поверхностью.
Когда металл погружается в электролит, на его поверхности образуется тонкий слой ионов, который называется двойным электрическим слоем. Этот слой является результатом взаимодействия ионов электролита с поверхностью металла и имеет значительное влияние на поведение этой системы.
Влияние электролитов на поверхность металла выражается в возникновении различных процессов, таких как окисление, образование пленки или осаждение металла из раствора. В результате этих процессов может происходить коррозия металла или, наоборот, его защита.
Конкретный вид взаимодействия металла с электролитом зависит от многих факторов, включая состав электролита, химическую активность металла и условия окружающей среды. Некоторые электролиты, такие как хлориды или сульфаты, могут вызывать интенсивные коррозионные процессы, в то время как другие электролиты, такие как натриевые или калиевые ионы, могут способствовать защите металла.
Изучение влияния электролитов на поверхность металла имеет большое значение для понимания и контроля процессов, связанных с электрохимической коррозией и защитой металлов от коррозии. Дальнейшие исследования в этой области позволят разрабатывать новые способы защиты металла от коррозии и повышать эффективность используемых методов.
Образование ионов металла и анионов соли при реакции

Реакция металла на соль происходит в результате образования ионов металла и анионов соли. При взаимодействии металла с солью, происходит обмен ионами, в результате которого образуются ионы металла и ионы соли.
Ионы металла представляют собой положительно заряженные частицы, которые образуются при потере одного или нескольких электронов металлом. Это происходит из-за того, что атомы металла имеют недостаток электронов во внешней электронной оболочке.
Ионы соли, в свою очередь, представляют собой отрицательно заряженные частицы, которые образуются при передаче одного или нескольких электронов от металла к аниону. Анионы - это отдельные атомы или группы атомов, которые имеют избыток электронов и, следовательно, отрицательный заряд. Они являются основными компонентами соли и определяют ее свойства.
Таким образом, в результате взаимодействия металла с солью, происходит образование ионов металла и анионов соли, которые взаимодействуют друг с другом, образуя новые соединения и обладая специфическими свойствами.
Химическое взаимодействие между металлом и солью

Химическое взаимодействие между металлом и солью является одним из основных процессов, которые происходят в химических реакциях. Когда металл контактирует с солью, происходит обмен ионами, что приводит к образованию новых веществ.
Металлы обладают способностью отдавать электроны, а соли, в свою очередь, состоят из положительно и отрицательно заряженных ионов. При контакте между ними, металлические ионы отдают электроны атомам соли, что приводит к образованию соединений различной природы.
Химическое взаимодействие между металлом и солью может протекать различными способами. Некоторые металлы реагируют с солями непосредственно, образуя твердые осадки или газы. Другие металлы могут растворяться в реакции с солями, образуя растворы и обесцвечивая их.
Одним из известных примеров химической реакции между металлом и солью является реакция между цинком и серной кислотой. При этой реакции образуется соль цинка и вода, причем оба реагента меняют свою структуру и свойства.
Таким образом, химическое взаимодействие между металлом и солью является сложным процессом, в результате которого происходит обмен ионами и образование новых соединений. Этот процесс имеет большое значение в химии и науке в целом, так как позволяет понять и объяснить множество явлений и реакций, происходящих в природе и в химической промышленности.
Реактивность различных металлов при контакте с солью

Реакция металлов на соль происходит на основе электрохимических процессов, которые зависят от активности металла и свойств соли. Каждый металл имеет свою степень реактивности, которая определяет его способность вступать в химические реакции с другими веществами.
Наиболее реактивными металлами являются щелочные металлы, такие как литий, натрий и калий. Они моментально реагируют с солью, образуя осадок или сплавы. Менее реактивные металлы, например, магний и алюминий, также могут вступать в реакции с солью, но более медленно.
Реакция металлов с солью может происходить в разных формах:
- Взаимодействие сольного раствора с поверхностью металла, при котором может образовываться покрытие или коррозия;
- Образование осадка на поверхности металла при смешении соли с металлическим раствором;
- Выделение газа в результате реакции металла с солью.
Соль может прежде всего влиять на металл за счет омоложения его поверхности, а также за счет изменения его химического состава. В результате этого могут происходить определенные реакции, такие как окисление, коррозия или образование новых соединений.
Реактивность металлов при контакте с солью имеет важное значение во многих практических сферах, например, в производстве и химической промышленности. Различные металлы используются для различных целей, учитывая их способность вступать в реакции с солями и другими веществами.
Влияние концентрации и температуры соли на реакцию с металлом

Концентрация и температура соли являются важными параметрами, которые влияют на характер и скорость реакции с металлом. При изменении этих параметров происходят изменения в реакционной среде и активности металла, что влияет на скорость и интенсивность процесса.
Повышение концентрации соли может ускорить реакцию с металлом. Это объясняется тем, что повышение концентрации соли в реакционной среде увеличивает количество реагирующих частиц, что ведет к увеличению вероятности их столкновения с металлом. Таким образом, чем выше концентрация соли, тем быстрее протекает реакция с металлом.
Температура также оказывает значительное влияние на реакцию с металлом. Увеличение температуры повышает скорость реакции, поскольку это приводит к увеличению энергии частиц. Высокая температура способствует активному движению молекул, что способствует более эффективным столкновениям между металлом и солью. Однако следует отметить, что слишком высокая температура может привести к дезактивации металла или изменению его свойств.
Итак, концентрация и температура соли оказывают существенное влияние на реакцию с металлом. Оптимальные условия для реакции могут быть достигнуты при определенных значениях концентрации и температуры соли. При изучении реакций металлов с солями необходимо учитывать эти факторы, чтобы достичь желаемых результатов и оптимальных условий для процесса.
Образование осадка и особенности его структуры

При взаимодействии металла с солью происходит образование осадка, который представляет собой нерастворимый продукт реакции. Это происходит благодаря образованию новых химических соединений, которые обладают низкой растворимостью в реакционной среде.
Структура осадка зависит от различных факторов, включая тип металла, соль и условия реакции. Осадок может иметь различные формы – от мелких кристаллов до плотных налетов на поверхности металла.
Одним из основных факторов, влияющих на структуру осадка, является скорость реакции. Если реакция происходит быстро, то осадок может иметь более мелкую структуру. В случае медленной реакции, осадок образуется постепенно, что может привести к образованию крупных кристаллов или слоев осадка.
Также важно отметить, что структура осадка может быть поверхностно-активной, то есть обладать свойствами, которые влияют на его растворимость и адгезию к поверхности металла. Это может приводить к образованию пленки на поверхности металла или изменению его свойств.
В некоторых случаях структура осадка может быть сложной и содержать различные компоненты. Например, при реакции металла с солью могут образовываться комплексы или соединения с примесями. Это может влиять на физические и химические свойства осадка.
Образование осадка и его структура являются важными аспектами в химических реакциях, так как они могут влиять на эффективность процесса и конечные свойства продукта.
Применение реакции металла на соль в различных отраслях промышленности

Реакция металла на соль имеет широкое применение в различных отраслях промышленности, где требуется высокая химическая активность металла и возможность образования солей.
В металлургической отрасли реакция металла на соль используется для получения металлических соединений. С помощью этой реакции производится получение сплавов, а также удаление примесей из металлов и их очистка. Также реакция металла на соль используется для термической обработки металлов, так как она позволяет изменять их структуру и свойства.
В химической промышленности реакция металла на соль используется для синтеза органических соединений. Например, металлы могут служить катализаторами при реакции гидрогенирования, при которой происходит взаимодействие металла с солью вещества. Также реакция металла на соль применяется для получения красителей, пигментов и других химических веществ, которые используются в производстве красок, лаков, пластиков и других материалов.
В пищевой промышленности реакция металла на соль применяется для консервирования пищевых продуктов. Металлические соли могут обладать антимикробными свойствами, что позволяет продлить срок годности продуктов и предотвратить их порчу. Кроме того, реакция металла на соль используется при приготовлении различных блюд, так как металлы могут взаимодействовать с пищевыми компонентами и изменять их вкус, аромат и цвет.
В электротехнической промышленности реакция металла на соль используется для образования гальванических элементов и аккумуляторов. При этой реакции происходит взаимодействие металла со солями в электролите, что позволяет получить электрический ток. Также реакция металла на соль применяется при покрытии металлических поверхностей защитными покрытиями для предотвращения коррозии и улучшения электропроводности.
Вопрос-ответ

Каким образом происходит взаимодействие металла с солью?
Взаимодействие металла с солью осуществляется путем химической реакции, в результате которой образуются новые вещества. Металл отдает электроны, становится положительным ионом, а анион из соли принимает электроны и образует новое соединение.
Почему металл реагирует с солью?
Металл реагирует с солью, потому что он имеет достаточно низкую энергию ионизации, то есть легко отдает электроны. При контакте с солью, которая имеет электронно-дефицитный анион, металл отдает свои электроны, чтобы установить электронную равновесие. Получив электроны, анион образует новое соединение с металлом.
