Металлы и кислоты – это два различных класса химических веществ, которые имеют способность взаимодействовать между собой в растворе. Взаимодействие металла с кислотой определяется рядом факторов, таких как концентрация кислоты, ее кислотность (pH), а также природа металла. Понимание основных условий такого взаимодействия имеет большое значение в различных научных и практических областях, включая химическую промышленность, медицину, строительство и другие.
Первым важным условием взаимодействия металла с растворами кислот является наличие ионов металла в растворе. Ионы металла могут возникать в результате различных химических реакций, включая окисление, растворение или реакцию с кислотой. Количество ионов металла в растворе зависит от многих факторов, таких как концентрация кислоты, температура, давление и другие условия.
Вторым важным условием является кислотность (pH) раствора. pH является показателем кислотности или щелочности раствора и определяется концентрацией ионов водорода (H+). Взаимодействие металла с кислотой может протекать при различных значениях pH. Например, некоторые металлы реагируют с сильными кислотами только в кислой среде, тогда как другие могут реагировать как в щелочной, так и в кислой среде. pH раствора влияет на скорость реакции металла с кислотой и может быть контролируемым параметром в различных технологических процессах.
Третьим важным условием является природа металла. Различные металлы обладают различной степенью активности и могут по-разному реагировать с кислотами. Например, активные металлы, такие как натрий или калий, реагируют с водой или сильными кислотами, образуя газы и воду. Некоторые металлы могут образовывать растворимые соли, а другие – инертные окисляющие или нерастворимые соединения. Природа металла определяет его взаимодействие с кислотой и его возможности использования в различных химических или технических процессах.
Взаимодействие металла с растворами кислот
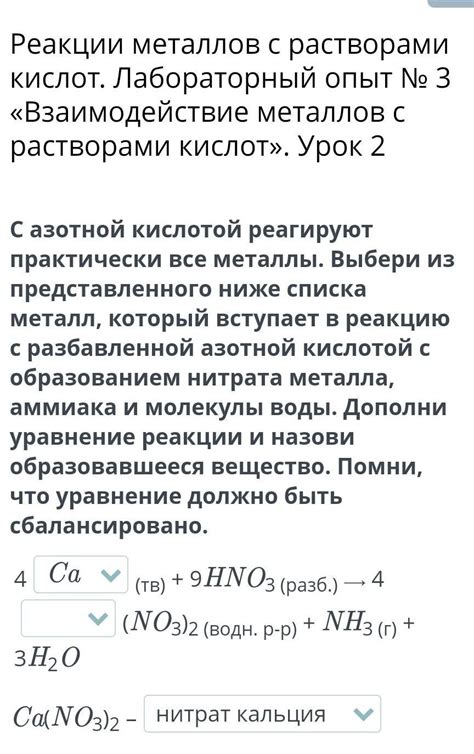
Металлы, вступая во взаимодействие с растворами кислот, проявляют разную активность в зависимости от своей природы и условий среды. При этом происходят различные химические реакции и образуются соответствующие продукты, которые могут быть как растворимыми, так и нерастворимыми.
Одним из самых распространенных типов реакций металла с кислотой является реакция замещения, когда металл вытесняет водород из молекулы кислоты. В результате образуются соответствующая соль металла и молекулы водорода. Например, реакция цинка с соляной кислотой приводит к образованию хлорида цинка и выделению пузырьков водорода:
- Zn + 2HCl → ZnCl2 + H2
Активность металлов определяется их способностью образовывать ионы в растворе и высвобождать электроны. Более активные металлы, такие как калий, натрий и литий, реагируют сильнее и быстрее с кислотами, чем менее активные металлы, такие как железо или медь.
Кроме реакции замещения, на других этапах взаимодействия металла с кислотой могут происходить окислительно-восстановительные процессы, в результате которых металл может потерять или приобрести электроны. Например, при взаимодействии цинка с серной кислотой образуются ионы цинка в двух степенях окисления:
- Zn + H2SO4 → ZnSO4 + H2
- 2Zn + 2H2SO4 → 2ZnSO4 + SO2 + 2H2O
В зависимости от условий среды, реакции металла с растворами кислот могут протекать с различной интенсивностью и образовывать различные соединения. Важными факторами, влияющими на характер реакции, являются концентрация кислоты, температура, наличие катализаторов и другие условия среды.
Реакция металла с кислотой: процесс и условия

Реакция металла с кислотой является одним из основных процессов в химии. При взаимодействии металла и кислоты происходит образование соли и выделение водорода. Этот процесс основан на протонной теории кислот и оснований, согласно которой кислота отдаёт протон, а металл принимает его, образуя ион металла.
Для успешного протекания реакции необходимо соблюдение определенных условий. Во-первых, металл должен быть активным, то есть иметь высокую активность кислорода и способность отдавать электроны. Такими металлами являются, например, цинк, железо, алюминий. Во-вторых, кислота должна быть достаточно сильной для того, чтобы принять электроны от металла. Сильные кислоты, такие как соляная или серная кислоты, обычно используются для этой реакции.
Также условием для протекания реакции металла с кислотой является наличие воды. Вода обеспечивает проводимость ионов и ускоряет реакцию. В процессе реакции происходит образование гидратированных ионов металла и кислоты, что способствует их взаимодействию и образованию соли.
Реакция металла с кислотой может протекать как под открытой, так и под закрытой системой. Под открытой системой понимается реакция, при которой образовавшийся газ (водород) выходит из реакционной смеси. Под закрытой системой понимается реакция, при которой образовавшийся газ (водород) запирается в реакционной смеси. Оба варианта реакции широко используются в химических исследованиях и в промышленности для получения солей и водорода.
Факторы, влияющие на скорость реакции

Скорость реакции между металлами и растворами кислот зависит от нескольких факторов, которые определяют эффективность и интенсивность процесса. Одним из главных факторов является концентрация раствора кислоты. Чем выше концентрация кислоты, тем быстрее происходит реакция с металлом. Это связано с тем, что большое количество ионов кислоты обеспечивает большее количество активных центров для взаимодействия с металлом и приводит к ускорению реакции.
Еще одним фактором, влияющим на скорость реакции, является температура раствора. При повышении температуры скорость реакции увеличивается. Это связано с тем, что при повышенной температуре молекулы раствора приобретают большую энергию, что ускоряет взаимодействие с металлом.
Важным фактором, который влияет на скорость реакции, является площадь поверхности металла. Чем больше площадь поверхности, тем больше активных центров для реакции предоставляется молекулам раствора, и тем быстрее происходит реакция. Поэтому, металлы в виде мелкой крошки или порошка реагируют быстрее, чем в виде кусков или проволоки.
Кроме того, скорость реакции между металлом и раствором кислоты зависит от силы кислоты. Сильные кислоты, такие как соляная или серная, реагируют быстрее со многими металлами, чем слабые кислоты, такие как уксусная или фосфорная. Это связано с тем, что сильные кислоты обладают большими электрофильными свойствами и легче вступают во взаимодействие с металлом.
Важность выбора правильной кислоты

При взаимодействии металла с растворами кислот важно правильно выбрать тип кислоты, так как это может оказать существенное влияние на процесс реакции и ее результаты. Реакция металла с кислотой вызывает образование солей и выделение водорода.
Выбор кислоты должен основываться на ряде факторов. Во-первых, важно учитывать активность металла: некоторые металлы реагируют только с определенными кислотами. Например, железо реагирует с соляной кислотой, но не реагирует с азотной кислотой. Другие металлы, такие как цинк, могут реагировать со множеством кислот, включая соляную, уксусную и серную.
Второй фактор, который следует учитывать, - это концентрация кислоты. Более концентрированные кислотные растворы могут вызывать более интенсивное взаимодействие с металлом и ускорять процесс реакции. Но при слишком высокой концентрации кислоты может происходить сильное коррозионное воздействие на металл, что может привести к его повреждению.
Кроме того, стоит учесть и химические свойства кислоты, такие как ее растворимость в воде и степень ее ионизации. Эти свойства могут влиять на скорость реакции металла с кислотой и образование соли. Например, соляная кислота обладает высокой степенью ионизации и хорошей растворимостью в воде, что делает ее одной из наиболее распространенных кислот для реакции с металлами.
Таким образом, выбор правильной кислоты является важным фактором в процессе взаимодействия металла с раствором кислоты. Правильный выбор кислоты позволит достичь нужных результатов и избежать негативных последствий для металла.
Последствия неправильного взаимодействия

Неправильное взаимодействие металла с растворами кислот может иметь серьезные последствия и приводить к различным проблемам. Одним из самых распространенных последствий является коррозия металла. Коррозия возникает при контакте металла с кислотой и приводит к его постепенному разрушению под воздействием химических реакций. В результате коррозии металла могут возникать трещины, дыры или облупленная поверхность, что снижает прочность и надежность конструкции.
Еще одним последствием неправильного взаимодействия металла с растворами кислот является образование взрывоопасных веществ. Некоторые металлы при воздействии кислоты могут выделять газы, которые обладают взрывоопасными свойствами. Это может привести к серьезным травмам и разрушениям окружающей среды. Поэтому особенно важно соблюдать правила безопасности при работе с металлами и кислотами, чтобы предотвратить такие опасные последствия.
Необходимо также учесть, что неправильное взаимодействие металла с растворами кислот может привести к загрязнению окружающей среды. Реакция металла с кислотой может вызвать образование токсичных или опасных веществ, которые могут попасть в почву, воду или воздух. Это может привести к нарушению экологического баланса и оказать вред живым организмам, в том числе человеку.
В целом, неправильное взаимодействие металла с растворами кислот может иметь серьезные последствия, связанные с ухудшением качества и надежности конструкции, возникновением взрывоопасных веществ и загрязнением окружающей среды. Поэтому при работе с металлами и кислотами необходимо соблюдать правила безопасности и проводить все работы в соответствии с требованиями технологического процесса.
Вопрос-ответ

Какие условия взаимодействия металла с растворами кислот являются основными?
Основными условиями взаимодействия металла с растворами кислот являются контакт металла с кислотой, образование ионов металла в растворе, а также выделение водорода при реакции.
Почему при взаимодействии металла с кислотой выделяется водород?
Выделение водорода при взаимодействии металла с кислотой объясняется процессом восстановления ионов водорода (H+) водородом (H2). При реакции между металлом и кислотой ионы водорода принимают электроны от металла, образуя молекулы водорода (H2).
