Взаимодействие металла с электролитом является одним из основных процессов, определяющих свойства и поведение металлических материалов. Этот процесс основан на электрохимических реакциях, которые происходят на поверхности металла при контакте с электролитом - раствором, содержащим ионные формы веществ.
Основными принципами взаимодействия металла с электролитом являются окислительно-восстановительные реакции и ионная передача электрического заряда. Во время окислительно-восстановительных реакций металл покрывается оксидным слоем или происходит выделение газов, что может приводить к коррозии металла. Ионная передача электрического заряда означает, что ионы, содержащиеся в электролите, переносятся на поверхность металла или от неё на другие объекты, вызывая электрохимические процессы.
Взаимодействие металла с электролитом может приводить к различным эффектам. Один из основных эффектов - коррозия металла. Коррозия возникает из-за химической реакции металла с окружающей средой, что приводит к его разрушению. В результате коррозии металл может лишиться своих материальных и структурных свойств, приводя к уменьшению его прочности и долговечности.
Однако взаимодействие металла с электролитом может быть также полезным процессом, например, в электрохимических аккумуляторах или в электросинтезе различных материалов. В этих случаях мы можем контролировать электрохимические процессы, чтобы получать нужные нам продукты или хранить энергию.
Взаимодействие металла с электролитом:
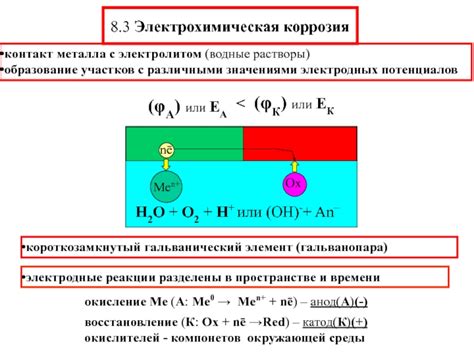
Взаимодействие металла с электролитом является одним из основных процессов в химической реакции между металлом и раствором электролита. При этом происходит образование электрической двойки, которая служит основой для различных электрохимических процессов, таких как покрытие поверхности металла, коррозия и электролиз.
Основной принцип взаимодействия металла с электролитом заключается в том, что металл предоставляет электроны, которые реагируют с ионами электролита, образуя осадок или раствор. При этом происходит окислительно-восстановительная реакция, где металл окисляется, а ионы электролита восстанавливаются.
Одним из основных эффектов взаимодействия металла с электролитом является образование тонкого защитного слоя на поверхности металла, который предотвращает его коррозию. Этот эффект особенно важен в промышленности, где металлические детали и конструкции подвержены агрессивной среде.
Кроме того, электролиз – это основной процесс взаимодействия металла с электролитом, который применяется в различных областях промышленности и науки. При электролизе происходит разложение вещества на ионы, которые двигаются под влиянием электрического поля в сторону анода или катода, в зависимости от их заряда. Этот процесс позволяет получать чистые металлы, проводить химические анализы и другие важные операции.
Химические реакции между металлом и электролитом

Взаимодействие металла с электролитом основано на химических реакциях, происходящих на границе раздела между металлом и раствором. При контакте металла с электролитом происходит обмен электронами между ионами раствора и атомами металла.
В зависимости от условий, химические реакции между металлом и электролитом могут быть различными. Например, при взаимодействии активного металла с кислотой происходит образование соли и выделение водорода. Это реакция окисления металла и восстановления водорода.
Другим примером химической реакции между металлом и электролитом является коррозия. Коррозия – это процесс разрушения металла под воздействием окружающей среды. Вода или влажный воздух могут действовать как электролиты и вызывать химическую реакцию окисления металла.
Одним из эффектов химических реакций между металлом и электролитом является образование покрытий на поверхности металла. Например, при анодной окислительной переработке алюминия в растворах солей алюминия образуется оксидное покрытие, которое защищает металл от дальнейшей коррозии.
Таким образом, химические реакции между металлом и электролитом играют важную роль в понимании и исследовании взаимодействия между различными материалами и окружающей средой.
Влияние состава электролита на взаимодействие с металлом
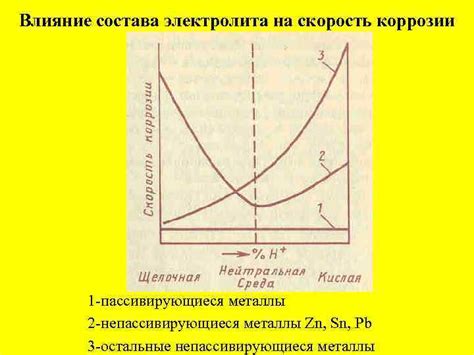
Состав электролита играет важную роль в процессе взаимодействия с металлом, определяя его химические реакции и свойства. Электролит состоит из растворенных ионов, которые могут быть положительными (катионами) или отрицательными (анионами). Именно эти ионы обеспечивают проводимость электролита и влияют на характер взаимодействия с металлом.
Различные ионы в электролите могут вызывать разнообразные эффекты на поверхности металла. Например, анионы могут образовывать пленки коррозии на поверхности, защищая металл от дальнейшего разрушения. Катионы же могут изменять реакцию металла с раствором, ускоряя или замедляя процессы окисления и восстановления.
Кроме того, влияние состава электролита на взаимодействие с металлом может проявляться и через изменение концентрации ионов в растворе. Высокая концентрация ионов может привести к ускоренной коррозии металла, так как больше ионов будет участвовать в реакциях на его поверхности. Низкая концентрация же может привести к замедленной коррозии, так как на поверхности металла будет меньше ионов для взаимодействия.
Таким образом, выбор электролита и его состава является ключевым фактором в взаимодействии с металлом, определяющим его химические реакции и степень коррозии. Подбор правильного электролита позволяет контролировать процессы окисления и восстановления, а также защищать металл от нежелательных эффектов, таких как коррозия и ржавчина.
---
Коррозия металла: основные причины и процессы

Коррозия металла - это процесс разрушения металлической поверхности под воздействием окружающей среды. Она может происходить в различных условиях и иметь разнообразные причины.
Одной из основных причин коррозии является реакция металла с водой или влажностью. При контакте с водой образуется электролитическая среда, которая способствует химическому разложению металла. В результате этого процесса образуются оксиды и гидроксиды металла, которые накапливаются на его поверхности и вызывают разрушение материала.
Еще одной причиной коррозии является воздействие агрессивных химических веществ, таких как кислоты, щелочи или соли. Они обладают высокой реактивностью и способны вызывать быстрое разрушение металла. Контакт с такими веществами может происходить как в промышленной среде, так и в повседневной жизни.
Также коррозия металла может быть вызвана электрохимическими процессами. В таком случае, металл играет роль анодной или катодной части электрохимической доли, что приводит к его разрушению. Этот процесс называется гальванической коррозией и происходит при наличии двух различных металлов или различных зон на одном металле.
Для защиты от коррозии применяются различные методы, включая напыление специальных защитных покрытий на поверхность металла, использование антикоррозионных покрытий или сплавов, а также контроль и поддержание определенного уровня влажности и состава окружающей среды.
---
Защита металла от химического взаимодействия с электролитом

Химическое взаимодействие металла с электролитом может привести к коррозии и разрушению материала. Для предотвращения этого процесса применяются различные методы защиты.
Один из таких методов – гальваническая защита. Она основана на принципе, что металл с более высоким потенциалом угребирает электролитическую коррозию металла с более низким потенциалом. Для этого на металл наводят специальный покрытие (например, цинк), которое является более активным по отношению к электролиту.
Другой метод – пассивация неподвижного слоя оксида. Речь идет о том, что при воздействии на металл кислорода или воды на поверхности создается защитный слой оксида, который препятствует дальнейшему проникновению электролита. Этот слой можно усилить путем нанесения покрытий, таких как хром или никель.
Нельзя также забывать о применении органических покрытий, например красок или лаков. Они создают барьер между металлом и электролитом, не позволяя им контактировать напрямую. Такие покрытия часто используются на металлических поверхностях автомобилей или металлоконструкций.
Также можно применять специальные антикоррозийные покрытия, которые образуют экологически стойкий слой на поверхности металла и препятствуют проникновению электролита. Такие покрытия могут состоять из различных соединений, включая полимеры, цинк или керамику.
И, наконец, очень важным методом защиты является выбор правильного материала для конкретного эксплуатационного условия. Некоторые металлы более устойчивы к коррозии, их выбор может предотвратить химическое взаимодействие с электролитом и сохранить целостность металлической конструкции.
Электролиз: процесс и его влияние на металл

Электролиз представляет собой процесс разложения веществ под воздействием электрического тока. Этот процесс основан на взаимодействии металла с электролитом, который служит проводником для тока. При электролизе металл может проходить различные преобразования, в зависимости от условий процесса.
Основным влиянием электролиза на металл является возможность его окисления или восстановления. При окислении металла около анода, происходит выделение кислорода, а сам металл становится положительно заряженными ионами, которые перемещаются к катоду. При восстановлении металла около катода, происходит выделение водорода, а металл набирает отрицательный заряд и перемещается к аноду.
Электролиз может также привести к образованию нежелательных осадков на поверхности металла. Если электролит содержит примеси, то они могут осаждаться на металле во время процесса электролиза. Это может привести к изменению свойств поверхности металла, например, к образованию пленки, ржавчины или осадка в виде особых соединений.
Следует отметить, что электролиз может быть использован для обратных процессов, когда требуется очистить металл от окислов или осадков. При этом, через электролит пропускают ток в обратном направлении, что позволяет восстановить металл и удалить нежелательные соединения с его поверхности.
Таким образом, электролиз является мощным инструментом для взаимодействия металла с электролитом, который может приводить к различным изменениям в свойствах и состоянии металла. Использование электролиза в различных отраслях промышленности позволяет получать металлы высокой чистоты и проводить обработку поверхности с высокой точностью и контролем процесса.
Электрохимический эффект при взаимодействии металла с электролитом

Взаимодействие металла с электролитом приводит к возникновению электрохимического эффекта, который существенно влияет на процессы окисления и восстановления металла. Электролит представляет собой раствор, содержащий положительно и отрицательно заряженные ионы, способные вступать в реакцию с поверхностью металла.
Один из основных электрохимических эффектов при взаимодействии металла с электролитом - это коррозия. Коррозия возникает при окислении поверхности металла в результате соединения его атомов или ионов с ионоами электролита. Этот процесс приводит к разрушению металла и образованию оксидов и гидроксидов на его поверхности.
Другим электрохимическим эффектом является обратная реакция - восстановление металла. Восстановление происходит, когда электролит играет роль окислителя и передает свои электроны на поверхность металла. В результате этой реакции на поверхности металла могут образовываться осадки в виде металла или соединений.
Для электрохимического взаимодействия металла с электролитом играют роль различные факторы, включая состав электролита, его концентрацию, pH и температуру. Изменение этих параметров может влиять на скорость электрохимической реакции и ее направленность.
Изучение электрохимического эффекта при взаимодействии металла с электролитом является важной задачей для понимания процессов коррозии и восстановления металлов, а также для разработки эффективных методов защиты от коррозии.
Электропроводность металла и ее связь с электролитом

Электропроводность металла — ключевая характеристика, определяющая способность вещества передавать электрический ток. Металлы обладают высокой электропроводностью благодаря своей кристаллической структуре. В ней есть свободные заряженные частицы — электроны — которые обеспечивают передачу тока. Отличительной особенностью металлов является то, что свободные электроны могут двигаться по всему объему вещества.
Когда металл погружается в электролит (раствор, содержащий заряженные ионы), происходит взаимодействие между ним и раствором. Это взаимодействие определяет множество эффектов, таких как электродные потенциалы, гальваническая коррозия и электрохимические реакции.
Когда проводимый через электролит электрический ток встречает металлический проводник, связанные с этим электроны переносят заряд и создают электрическое поле вокруг проводника. Это поле влияет на ионы электролита, приводя к электродным реакциям и переносу заряда через границу между металлом и электролитом.
Значение электропроводности металла связано с его физическими свойствами, такими как мобильность электронов и концентрация свободных электронов. Чем больше электропроводность металла, тем легче электрический ток будет проходить через него.
Взаимодействие металла с электролитом сопровождается рядом явлений, таких как положительные и отрицательные электродные потенциалы, коррозия металла, изменение растворимости ионов. Понимание этих явлений и их влияние на процессы электропроводности металла и электролита имеет большое практическое значение и используется в различных областях, включая электрохимию, электротехнику и материаловедение.
Электрофорез и его роль в металлургии

Электрофорез – важный процесс в металлургии, основанный на воздействии электрического поля на металлические частицы в водной среде. В результате этого процесса происходит перемещение частиц под воздействием электрических сил, что позволяет получить чистые и однородные металлические покрытия.
Одно из основных применений электрофореза в металлургии – нанесение защитных покрытий на металлические изделия. Покрытия, полученные с помощью электрофореза, обладают высокой стойкостью к коррозии, что делает их незаменимыми в различных отраслях промышленности.
Процесс электрофореза основан на движении заряженных частиц под воздействием электрического поля. Заряженные металлические ионы перемещаются к электроду противоположного знака, где осуществляется их осаждение на поверхности металла. Таким образом, электрофорез позволяет получить равномерное и прочное покрытие на металлическом изделии.
Для проведения электрофореза используют специальные ванночки с электролитом, содержащим металлические ионы. Электролит может быть различным в зависимости от требуемых свойств покрытия. Наиболее часто используемыми электролитами являются растворы солей, например, хлорида железа или хлорида цинка.
Важным аспектом электрофореза является правильный подбор параметров процесса, таких как напряжение и время воздействия. Неправильный выбор этих параметров может привести к неравномерности покрытия или даже его отсутствию. Поэтому, для достижения оптимального результата, необходимо проводить тщательное исследование и контроль процесса электрофореза.
Таким образом, электрофорез играет важную роль в металлургии, позволяя получать высококачественные и стойкие покрытия на металлических изделиях. Он находит широкое применение в различных отраслях промышленности, включая автомобильную, электронную и медицинскую области.
Вопрос-ответ

Как происходит взаимодействие металла с электролитом?
Взаимодействие металла с электролитом основано на процессе электрохимической реакции. Когда металл находится в контакте с электролитом, происходит передача электронов между атомами металла и молекулами электролита. При этом металл может окисляться, отдавая электроны (анодный процесс), или восстанавливаться, принимая электроны (катодный процесс).
Какие основные принципы лежат в основе взаимодействия металла с электролитом?
Основными принципами взаимодействия металла с электролитом являются окислительно-восстановительная реакция и процессы диффузии. Во время окислительно-восстановительной реакции, которая происходит на электроде, происходит трансфер электронов между металлом и электролитом. Процессы диффузии включают перемещение ионов электролита вдоль границы между металлом и раствором.
Какие эффекты возникают при взаимодействии металла с электролитом?
При взаимодействии металла с электролитом может возникать несколько эффектов. Один из них - коррозия металла, которая происходит из-за окисления металла и разрушения его структуры под воздействием агрессивной среды. Другим эффектом является электрохимическая обработка металла, которая используется для нанесения покрытий, а также для очистки и полировки поверхности металла. Также возможно образование катодных и анодных областей на поверхности металла в результате различных химических реакций.
