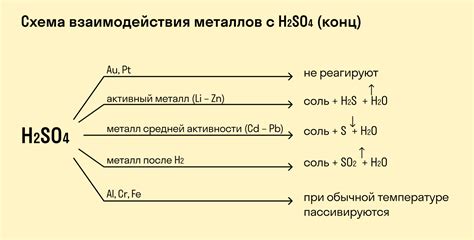
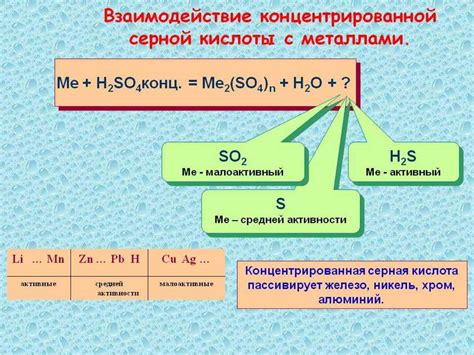
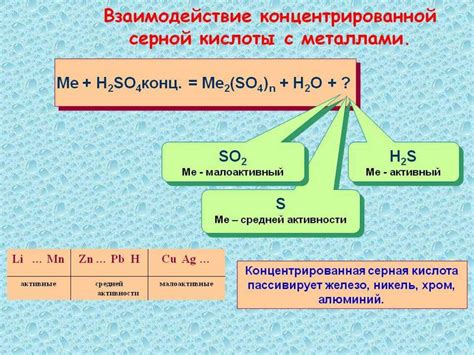
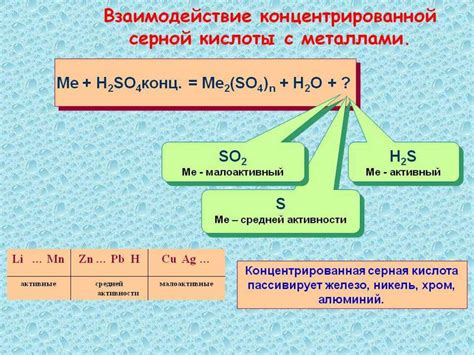
Концентрированная серная кислота является одним из самых сильных и коррозионно-активных окислителей в химии. Она обладает способностью взаимодействовать с различными металлами и проводить реакции окисления, при которых металл переходит из нейтрального состояния в положительное ионное состояние.
Уравнение реакции между концентрированной серной кислотой и металлом представляет собой химическое уравнение, описывающее все субстанции, принимающие участие в этом процессе, и их изменение состояния в результате реакции. Оно позволяет представить и сравнить количество и типы реагентов и продуктов реакции, а также влияние температуры, концентрации и других факторов на скорость и итоговый результат реакции.
Уравнение реакции взаимодействия концентрированной серной кислоты с металлами может быть записано в следующем виде: H2SO4 + M -> MSO4 + H2↑, где H2SO4 - серная кислота, M - металл, MSO4 - соль соответствующего металла и H2 - водород. В данной реакции серная кислота действует как окислитель, а металл - как восстановитель, поскольку передает электроны серной кислоте, формируя положительно заряженные ионы металла и молекулы водорода.
Реакция концентрированной серной кислоты с металлами

Концентрированная серная кислота – это сильное окислительное вещество, которое проявляет свою активность при взаимодействии с металлами. Реакция такого взаимодействия происходит с выделением водорода и образованием сульфатов.
В результате этой реакции происходит диспропорционирование серной кислоты: одна ее часть окисляется, а другая восстанавливается.
При взаимодействии серной кислоты с активными металлами, такими как железо, цинк, никель, происходит образование сульфатов металлов и выделение водорода. Взаимодействие происходит по следующей реакции:
H2SO4 + M = MSO4 + H2,
где M – металл, а MSO4 – соответствующий сульфат.
Реакции между серной кислотой и металлами являются экзотермическими, то есть сопровождаются выделением тепла. При добавлении концентрированной серной кислоты на поверхность металла образуется эффектное вспыхивание, связанное с образованием легко воспламеняющихся соединений.
Реакции серной кислоты с металлами широко используются в химическом производстве, например, при получении сульфата цинка, который применяется в гальванической, стекольной и медицинской промышленности.
Взаимодействие серной кислоты и щелочных металлов
Серная кислота является одним из основных кислотных соединений и обладает сильными кислотными свойствами. Одним из типичных реагентов, с которыми происходит взаимодействие серной кислоты, являются щелочные металлы - натрий (Na), калий (K) и литий (Li).
В результате реакции между серной кислотой и щелочными металлами образуется соль и выделяется водород. Уравнение реакции можно записать следующим образом:
H2SO4 + 2Na → Na2SO4 + 2H2
В процессе взаимодействия серной кислоты с щелочными металлами происходит замещение водорода атомами металла. Металл активно вступает во взаимодействие, образуя соль серной кислоты. Водород выделяется в виде газа.
Реакция между серной кислотой и щелочными металлами происходит с выделением значительного количества тепла. При этом образуется сильно концентрированная серная кислота, которая может быть опасна для человека и окружающей среды.
Взаимодействие серной кислоты и щелочных металлов является одной из классических химических реакций и активно применяется в промышленности и лабораторной практике.
Реакция серной кислоты с щелочноземельными металлами
Серная кислота (H2SO4) является сильной двухосновной кислотой, обладающей высокой степенью диссоциации в водном растворе. Взаимодействие этой кислоты с щелочноземельными металлами протекает с образованием соответствующих солей и выделением водорода.
Реакция серной кислоты с щелочноземельными металлами можно представить следующим уравнением:
2H2SO4 + M → MSO4 + 2H2O + H2
где M обозначает щелочноземельный металл, такой как магний (Mg), кальций (Ca), стронций (Sr) или барий (Ba).
Реакция происходит с выделением водорода, который можно обнаружить по характерным признакам: горение с пламенем и характерным звуком. Полученная соль является сульфатом щелочноземельного металла и может иметь различные применения, например, в производстве удобрений или в фармацевтической промышленности.
Реакция серной кислоты с щелочноземельными металлами является типичным примером реакции образования соли и выделения водорода при взаимодействии кислоты с металлом. Она имеет большое практическое значение и широко используется в различных отраслях промышленности.
Взаимодействие концентрированной серной кислоты с переходными металлами

Концентрированная серная кислота, химическая соединение формула H2SO4, является сильным окислителем и противоречивым агентом. При взаимодействии с переходными металлами, такими как железо, медь и никель, происходят различные реакции, обусловленные способностью кислоты отбирать электроны у металлических атомов.
Реакция концентрированной серной кислоты с железом приводит к образованию двух основных продуктов - сульфата железа(II) и сероводорода. В результате окисления железа кислородом из кислоты образуется сульфат железа, который остается в растворе. Сероводород же образуется вследствие восстановления серы, присутствующей в кислоте. В общей сумме реакции можно записать уравнение:
Fe + H2SO4 → FeSO4 + H2S
Взаимодействие концентрированной серной кислоты с медью ведет к формированию сульфата меди(II) и оксидов серы. В реакции происходит окисление меди до двухвалентного катиона и восстановление серы:
Cu + H2SO4 → CuSO4 + SO2 + H2O
Взаимодействие концентрированной серной кислоты с никелем вызывает образование сульфата никеля(II) и серы:
Ni + H2SO4 → NiSO4 + SO2 + H2O
Таким образом, взаимодействие концентрированной серной кислоты с переходными металлами приводит к различным реакциям, обусловленным способностью кислоты окислять металлы и восстанавливать серу. Эти реакции являются важной частью химии переходных металлов и могут быть использованы в различных промышленных и лабораторных процессах.
Реакция серной кислоты с благородными металлами
Серная кислота – это одна из самых распространенных и важных неорганических кислот. Она обладает сильными окислительными свойствами и может взаимодействовать с различными веществами, включая металлы. В данном случае рассмотрим реакцию серной кислоты с благородными металлами, такими как золото, платина и серебро.
Реакция серной кислоты с благородными металлами протекает следующим образом. Вначале благородный металл растворяется в серной кислоте, образуя сернистокислые соединения. Например, при реакции золота с серной кислотой образуется пурпурная растворимая соль – золотасть сернистокислого. При этом серная кислота действует как окислитель, переходя в сернокислую форму.
Реакция серной кислоты с благородными металлами не является интенсивной и происходит медленно. Она не образует обильного выделения газов или образования пены, которые характерны для некоторых других реакций сильных окислителей. Результаты данной реакции могут быть использованы для получения соединений благородных металлов, которые имеют разнообразные применения в различных отраслях промышленности и научных исследований.
Таблица ниже представляет перечень некоторых благородных металлов и соответствующих соединений, образующихся в результате реакции с концентрированной серной кислотой:
| Металл | Соединение, образующееся при реакции |
|---|---|
| Золото | Золотасть сернистокислого |
| Платина | Платиновасть сернистокислого |
| Серебро | Серебряность сернистокислого |
Таким образом, реакция серной кислоты с благородными металлами является важным процессом, позволяющим получать соединения этих металлов с различными целями. Она проводится с использованием концентрированной серной кислоты и протекает медленно, образуя соответствующие сернистокислые соединения.
Взаимодействие серной кислоты с амфотерными металлами

Амфотерные металлы – это группа химических элементов, которые могут проявлять свойства как металлов, так и неметаллов. К ним относятся, например, алюминий, цинк, железо и медь. Имея способность взаимодействовать как с кислотами, так и с щелочами, амфотерные металлы обладают особым химическим поведением.
Взаимодействие серной кислоты с амфотерными металлами является одной из наиболее распространенных реакций в химической лаборатории. При контакте серной кислоты с амфотерными металлами происходит образование солей и выделение водорода.
В обычных условиях амфотерные металлы реагируют с серной кислотой, вытесняя из нее металл. Реакция протекает по следующему уравнению:
- Серная кислота (H2SO4) + Металл (M) → Соль (MSO4) + Водород (H2)
При этом образовавшийся газ водород можно обнаружить по характерному шипящему звуку, который сопровождает реакцию.
Важно отметить, что реакция между серной кислотой и амфотерными металлами является экзотермической, то есть сопровождается выделением тепла. Поэтому при проведении данной реакции необходимо соблюдать меры предосторожности и работать с веществами в химическом шкафу или вентилируемом помещении.
Реакция серной кислоты с пассивированными металлами
Серная кислота (H2SO4) – это одна из наиболее широко используемых кислот в химической промышленности. Известно, что серная кислота может взаимодействовать с металлами, образуя соли. Однако, некоторые металлы обладают защитной пленкой, которая пассивирует их поверхность и предотвращает дальнейшее взаимодействие с кислотой.
Пассивированные металлы, такие как алюминий, хром, титан и нержавеющая сталь, образуют тонкую оксидную пленку на своей поверхности, которая предотвращает проникновение серной кислоты. Эта пленка является непроницаемой и стабильной, обеспечивая защиту металла от коррозии.
Такое пассивирование происходит благодаря реакции металла с кислородом в воздухе или воде, в результате которой образуется оксид. Например, алюминий реагирует с кислородом воздуха, образуя оксид алюминия (Al2O3), который предотвращает дальнейшее действие серной кислоты.
Важно отметить, что пассивированные металлы все же могут растворяться в серной кислоте при определенных условиях. Например, при наличии водородной перекиси или хлоридных и иных агрессивных ионов. Поэтому, при работе с серной кислотой необходимо принимать меры предосторожности для предотвращения возможности повреждения пассивирующей пленки и коррозии металла.
Кроме того, в данном случае важно учесть, что металлы различаются по своей способности к пассивированию. Например, нержавеющая сталь обладает высокой степенью пассивирования и образует стабильную пленку, в то время как алюминий может легко разрушить пассивирующую пленку при повреждении и вступить в реакцию с серной кислотой.
Вопрос-ответ

Каково уравнение реакции взаимодействия концентрированной серной кислоты с металлами?
Уравнение реакции зависит от конкретного металла, но в общем случае оно выглядит следующим образом: H2SO4 + M = MSO4 + H2, где H2SO4 - концентрированная серная кислота, M - металл, MSO4 - сульфат металла, H2 - молекула водорода.
Какие свойства концентрированной серной кислоты делают ее реактивом взаимодействия с металлами?
Концентрированная серная кислота обладает высокой кислотностью, диссоциативностью и окислительными свойствами. Благодаря этим свойствам она активно реагирует с металлами, образуя сульфаты металлов и выделяя водород.
Какие металлы могут реагировать с концентрированной серной кислотой?
С концентрированной серной кислотой могут реагировать различные металлы, включая активные металлы, такие как железо, цинк, алюминий, магний, свинец, никель, медь и другие. Они реагируют с кислотой, образуя соответствующий сульфат металла и выделяя молекулы водорода.
Какие факторы влияют на скорость реакции между концентрированной серной кислотой и металлом?
Скорость реакции зависит от различных факторов, таких как концентрация серной кислоты и металла, температура, поверхностная активность металла и наличие катализаторов. Более концентрированная кислота и повышенная температура обычно ускоряют реакцию, а повышенная поверхностная активность металла или добавление катализаторов могут также увеличить скорость реакции.
