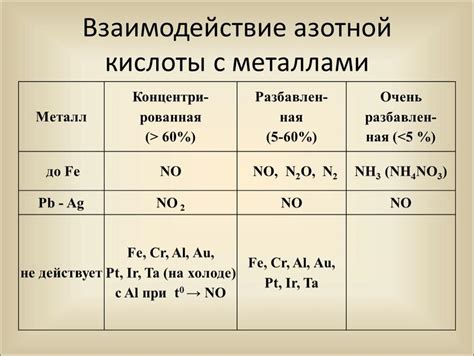
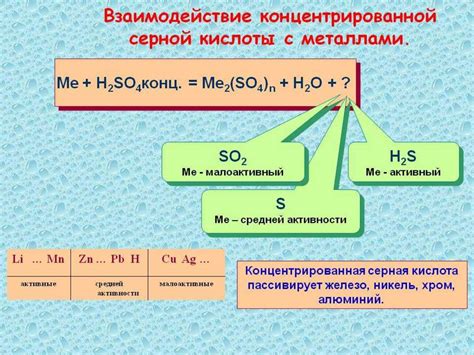
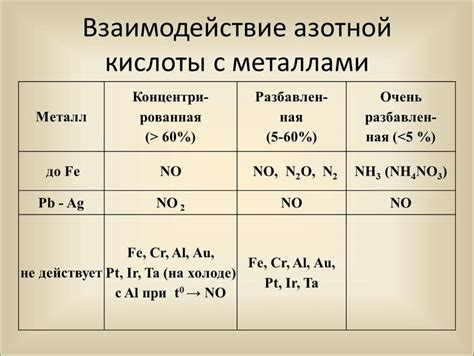
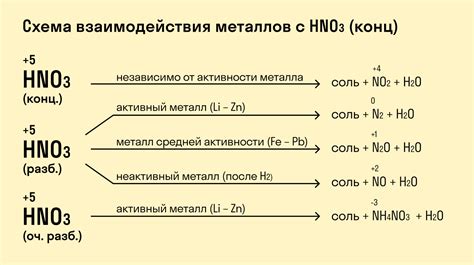
Реакция азотной кислоты с металлами представляет собой классический пример окислительно-восстановительной реакции. Азотная кислота (HNO3) обладает сильными окислительными свойствами и может реагировать с различными металлами, такими как медь, цинк, железо и др.
Когда азотная кислота вступает в реакцию с металлом, происходит окисление металла и одновременное восстановление ионов азота. В результате реакции образуется газ, который может быть в виде оксида азота (NO), диоксида азота (NO2) или аммиака (NH3), в зависимости от условий реакции и свойств металла.
Для проведения реакции необходимо использовать концентрированную азотную кислоту, так как она обладает высокой концентрацией HNO3. При реакции с металлом происходит выделение значительного количества тепла, что может привести к возгоранию. Поэтому реакции с концентрированной азотной кислотой следует проводить с осторожностью и в специально оборудованных условиях.
Механизм образования газа при реакции азотной кислоты с металлами
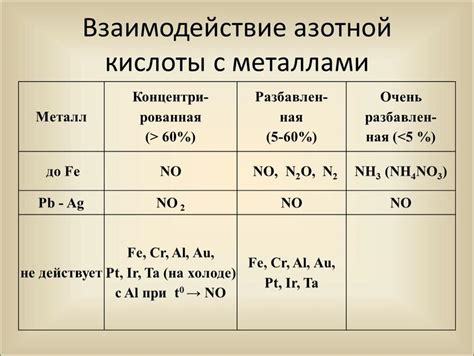
Реакция металлов с азотной кислотой приводит к образованию газа. Этот процесс основан на взаимодействии кислоты с металлической поверхностью и последующей реакции, в результате которой образуется аммиак (NH3).
При взаимодействии азотной кислоты с металлом, первоначально происходит диссоциация кислоты на ионы гидроксония (H3O+) и нитратные ионы (NO3-). Далее ионы гидроксония реагируют с поверхностью металла, образуя воду и выделяя протоны. Это представляет собой окислительно-восстановительную реакцию, при которой металл окисляется, а ионы гидроксония восстанавливаются.
После окисления металла и выделения протонов, образовавшиеся ионы нитрата реагируют с протонами, образуя воду и аммиак. Реакция протонов с ионами нитрата и последующая реакция протонов с ионами гидроксония представляют собой типичные протолитические реакции.
Аммиак, образовавшийся в результате взаимодействия азотной кислоты с металлом, является сильным основанием и может широко использоваться в различных промышленных процессах и химических реакциях.
Азотная кислота: свойства и химический состав
Азотная кислота, также известная как разбавленная азотная кислота или концентрированная азотная кислота, является одним из наиболее распространенных неорганических кислот. Ее химическая формула HNO3. Азотная кислота имеет свойство легко разлагаться на вещества, содержащие воду, и является очень коррозионно-активной соединительной вещью.
Азотная кислота обладает характерными физическими и химическими свойствами. Она представляет собой безцветную жидкость, имеющую характерный запах. Азотная кислота является сильным окислителем и очень реактивным веществом. Она способна коррозировать различные металлы, образуя при этом соли азотнокислых металлов и выделяя при этом нитрогенокислородный газ (NO2).
Азотная кислота широко используется в различных отраслях промышленности. Она является важным компонентом при производстве различных видов удобрений и продуктов питания. Азотная кислота также используется в процессе производства взрывчатых веществ и различных фармацевтических препаратов.
Следует отметить, что азотная кислота является опасным химическим веществом и требует особой осторожности при хранении и использовании. Неправильное обращение с азотной кислотой может привести к серьезным последствиям для здоровья и окружающей среды. При работе с азотной кислотой необходимо соблюдать все предписания и меры предосторожности, чтобы избежать аварийных ситуаций и несчастных случаев.
Классификация металлов по их реакционной способности
Металлы в реакциях с азотной кислотой могут образовывать различные соединения и выделять газы. Однако, наличие реакции и скорость ее протекания зависит от реакционной способности металла. Существует несколько групп металлов, классифицированных по их реакционной способности.
В первую группу входят самые активные металлы, которые реагируют с азотной кислотой с выделением газа уже при комнатной температуре. К этой группе относятся такие металлы, как калий, натрий и литий. Реакция с азотной кислотой протекает очень быстро и образуется обильное количество газа. При этом раствор нитрата металла также образует обильное количество газа при взаимодействии с металлом.
Во вторую группу входят металлы, реакция которых с азотной кислотой происходит при нагревании. К этой группе относятся такие металлы, как магний, алюминий и цинк. В отличие от первой группы, реакция этих металлов происходит медленнее, но также с выделением газа и образованием нитратов металлов.
В третью группу входят менее активные металлы, реакция которых с азотной кислотой не происходит или происходит слишком медленно. Это, например, железо, медь и свинец. Реакция этих металлов с азотной кислотой требует высокой температуры и продолжительного нагревания. При этом образовывается нитрат металла и газ.
Химическая реакция азотной кислоты с активными металлами
Азотная кислота (HNO3) – это одна из самых известных и широко применяемых кислот в химической промышленности и лабораторном анализе. При взаимодействии азотной кислоты с некоторыми активными металлами происходит химическая реакция, сопровождающаяся образованием газа.
В процессе взаимодействия азотной кислоты с активными металлами, такими как натрий (Na), калий (K) или магний (Mg), происходит выделение диоксида азота (NO2) в виде газа. Химическое уравнение этой реакции выглядит следующим образом:
- 2HNO3 + 4Na → 2NaNO3 + O2 + 2NO2
- 4HNO3 + 10K → 4KNO3 + 2H2O + 5O2 + 2NO2
- 8HNO3 + 3Mg → 3Mg(NO3)2 + 4H2O + 5O2 + 2NO2
Все эти реакции проходят с образованием газа, что очень характерно для химических реакций с участием активных металлов. Диоксид азота – это коричневато-красный газ со специфичным запахом, который является продуктом этой реакции.
Образующийся газ, в данном случае диоксид азота, может быть использован в различных промышленных процессах. Он широко применяется в производстве красителей, промышленных удобрений, взрывчатых веществ и других химических соединений.
Таким образом, реакция азотной кислоты с активными металлами является важным и полезным процессом, который приводит к образованию диоксида азота и может быть использован в различных промышленных отраслях.
Влияние концентрации азотной кислоты на образование газа

Концентрация азотной кислоты является одним из ключевых факторов, влияющих на образование газа в результате ее реакции с металлами. Чем выше концентрация кислоты, тем интенсивнее протекает реакция и больше газа образуется.
При повышении концентрации азотной кислоты в реакционной смеси происходит увеличение количества активных ионов, способствующих образованию газа. Это объясняется тем, что более высокая концентрация кислоты обеспечивает большее количество частиц, которые могут участвовать в реакции с металлом.
Повышение концентрации азотной кислоты также приводит к более интенсивному протеканию реакции растворения металла и образованию соответствующих солей. Это, в свою очередь, ведет к увеличению количества реагирующих частиц и, как следствие, к большему образованию газа.
Следует отметить, что концентрация азотной кислоты не может быть слишком высокой, поскольку при слишком сильном окисляющем действии кислоты на металл может происходить дальнейшее разложение образовавшегося газа или даже возникнуть взрывоопасная ситуация.
В целом, увеличение концентрации азотной кислоты влияет на образование газа при реакции с металлами, обеспечивая более интенсивное протекание реакции и увеличение количества образующегося газа. Однако необходимо учитывать, что слишком высокая концентрация может создать ряд опасностей и требует предварительного осторожного изучения условий эксперимента.
Скорость реакции и условия ее протекания

Скорость реакции образования газа при взаимодействии концентрированной азотной кислоты с металлами зависит от различных факторов и условий протекания реакции. Одним из важных факторов является концентрация самих реагентов. Чем выше концентрация азотной кислоты, тем быстрее протекает реакция с металлом и образование газа.
Также значительное влияние на скорость реакции оказывает температура. При повышении температуры происходит активация молекул азотной кислоты и металла, что ускоряет их взаимодействие и образование газа. Однако при очень высоких температурах реакция может протекать слишком быстро и неуправляемо, что может быть опасно.
Также на скорость реакции влияет поверхность металла. Чем больше площадь поверхности металла, тем больше молекулярных контактов между металлом и азотной кислотой, что увеличивает скорость реакции и образование газа.
Кроме того, на скорость реакции могут оказывать влияние катализаторы. Катализаторы способствуют активации молекул реагентов и создают благоприятные условия для их взаимодействия. Наличие катализатора может значительно ускорить реакцию и повысить ее эффективность.
Окончательная скорость реакции и условия ее протекания зависят от сочетания всех перечисленных факторов. Правильный выбор концентрации реагентов, температуры, поверхности металла и использование катализаторов позволяет достичь оптимальных условий протекания реакции и обеспечить высокую скорость образования газа при взаимодействии концентрированной азотной кислоты с металлами.
Практическое применение реакции образования газа

Реакция образования газа при взаимодействии концентрированной азотной кислоты с металлами находит широкое применение в различных областях науки и техники.
Одно из практических применений этой реакции связано с производством удобрений. Горячий азотной кислотой металл, такой как алюминий или цинк, производят азотнокислые соли. Азотнокислые соли в дальнейшем могут использоваться в качестве основного компонента удобрений. Это позволяет эффективно использовать азот из атмосферы в растениях и повысить урожайность.
Другое применение реакции образования газа связано с производством взрывчатых веществ. Концентрированная азотная кислота может служить источником кислорода для окисления органических соединений в процессе синтеза взрывчатых веществ. Реакция образования газа при этом играет важную роль в образовании дополнительного газового фазы, необходимой для усиления эффекта взрыва.
В биохимии реакция образования газа при взаимодействии азотной кислоты с металлами используется для изучения активности дефероксамина - вещества, способного образовывать хелаты с ионами железа и других металлов. Реакция образования газа позволяет определить количество активных центров дефероксамины и исследовать ее в условиях, близких к физиологическим.
Вопрос-ответ

Как происходит образование газа при реакции концентрированной азотной кислоты с металлами?
При реакции концентрированной азотной кислоты с металлами, такими как цинк или медь, происходит образование азотного газа. Эта реакция происходит по экзотермическому механизму, при котором азотная кислота окисляет металл, образуя оксид металла и высвобождая молекулы азотного газа.
Какие металлы реагируют с концентрированной азотной кислотой?
Многие металлы могут реагировать с концентрированной азотной кислотой, включая цинк, железо, медь и свинец. При этом реакция зависит от химических свойств металла, его реакционной способности и устойчивости кислоты. Например, цинк активно реагирует с азотной кислотой, образуя азотные оксиды и воду.
Какова роль азотной кислоты в реакции с металлами?
Азотная кислота играет роль окислителя в реакции с металлами. Она способна окислять металлы путем передачи электронов, что ведет к образованию оксидов металлов и выделению молекул азотного газа. Таким образом, азотная кислота участвует в окислительно-восстановительной реакции с металлами и обеспечивает выделение газа.