Кислоты являются важными химическими веществами, которые широко используются в промышленности и научных исследованиях. Одной из основных характеристик кислоты является их способность взаимодействовать с металлами и вызывать реакции. Скорость таких реакций может быть различной в зависимости от конкретных условий и свойств используемой кислоты и металла.
Одним из факторов, влияющих на скорость реакции кислоты с металлами, является концентрация кислоты. С увеличением концентрации кислоты скорость реакции также может увеличиваться. Это связано с тем, что большее количество кислоты имеет больше активных частиц, способных взаимодействовать с поверхностью металла, что приводит к увеличению числа реакций и, соответственно, к повышенной скорости.
Еще одним важным фактором является химическая активность кислоты и металла. Некоторые кислоты, такие как серная и соляная, обладают высокой химической активностью и могут вызывать быстрые реакции с металлами. Более активные металлы, такие как цинк и алюминий, также обладают большей способностью реагировать с кислотами и, следовательно, образуют более быстрые реакции.
Наконец, температура является существенным фактором, влияющим на скорость реакции кислоты с металлами. При повышении температуры молекулы кислоты и металла обладают большей кинетической энергией, что способствует увеличению числа успешных столкновений и, следовательно, увеличению скорости реакции.
В целом, скорость реакции кислоты с металлами зависит от нескольких факторов, таких как концентрация кислоты, химическая активность кислоты и металла, а также температура. Понимание этих факторов позволяет улучшать процессы взаимодействия кислоты с металлами и оптимизировать их применение в различных отраслях промышленности и научных исследованиях.
Роль кислоты в химических реакциях с металлами

Кислоты играют важную роль в химических реакциях с металлами, так как они способны возбуждать и ускорять эти реакции. Взаимодействие кислоты и металла приводит к образованию солей и облегчает процесс распада металлической структуры.
Кислоты обладают электрохимической активностью и энергией, способной активизировать процессы окисления и восстановления. Когда металл погружается в кислотный раствор, происходит образование активных ионов металла, которые становятся доступными для реагирования с другими веществами.
Одним из наиболее важных эффектов в химических реакциях металла с кислотой является образование водорода. Металл активно взаимодействует с долей воды в кислотном растворе, образуя гидроксиды и освобождая молекулы водорода. Это приводит к выделению пузырьков газа и ощутимому повышению активности реакции.
Скорость реакции металла с кислотой зависит от различных факторов, включая концентрацию кислоты, поверхность металла, температуру и присутствие катализаторов. Более сильные кислоты, такие как соляная кислота и серная кислота, обладают большей активностью и способностью более быстро реагировать с металлом.
Кроме того, кислоты могут влиять на характер реакции металла с кислородом. Они могут служить окислителями и способствовать образованию оксидов металла. Некоторые кислоты также могут ощутимо изменять цветовую окраску металлических ионов, что является важным экспериментальным фактором при изучении этих реакций.
Что такое кислота и как она взаимодействует с металлами?
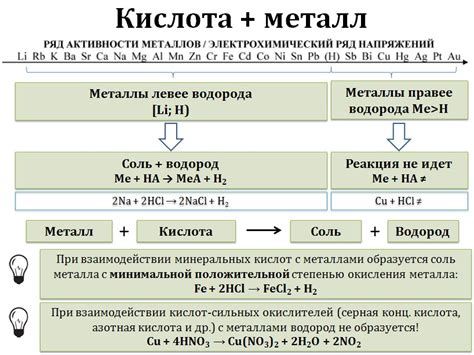
Кислота - это химическое вещество, способное отдавать протоны, обычно в водном растворе. Кислоты обладают кислотными свойствами и могут реагировать с различными веществами, в том числе с металлами. Взаимодействие кислот с металлами является одним из фундаментальных процессов в химии.
Реакция кислоты с металлом называется металлокислотной реакцией. Когда металл контактирует с кислотой, происходит образование соли и выделение водорода. Это связано с тем, что кислоты, отдавая протоны, образуют положительно заряженные ионы (катионы), а металлы способны отдавать электроны, образуя отрицательно заряженные ионы (анионы). Таким образом, происходит обмен ионами между кислотой и металлом, что приводит к образованию соли металла.
Скорость реакции кислоты с металлом зависит от различных факторов, таких как концентрация кислоты, температура, поверхность металла и его активность. Концентрированные кислоты обычно реагируют с металлами более быстро, чем разбавленные. Повышение температуры также ускоряет реакцию, так как это увеличивает скорость движения молекул и ионов.
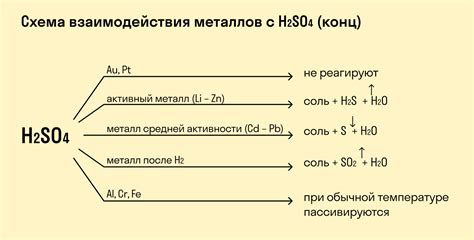
Важно отметить, что не все металлы реагируют с кислотами. Некоторые металлы, такие как золото или платина, химически инертны и почти не реагируют с кислотами. Однако большинство активных металлов, таких как натрий, калий или алюминий, реагируют с кислотами легко и образуют соли и водород.
Металлокислотные реакции имеют широкий спектр применений. Например, они используются в производстве металлических солей, водорода и других химических соединений. Кроме того, эти реакции играют важную роль в химическом анализе и исследованиях в области химии.
Факторы, влияющие на скорость реакции кислоты с металлами
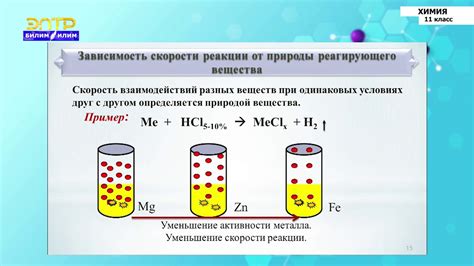
Скорость реакции кислоты с металлами зависит от нескольких факторов, которые определяют, как быстро реакция протекает. Один из основных факторов - концентрация кислоты. Чем выше концентрация кислоты, тем быстрее будет протекать реакция с металлом. Более концентрированная кислота обладает большим количеством активных частиц, что способствует более быстрой реакции.
Другой важный фактор - поверхность металла. Чем больше поверхность металла, с которым вступает в реакцию кислота, тем выше будет скорость реакции. Это объясняется тем, что большая поверхность обеспечивает более активные точки контакта между кислотой и металлом, что ускоряет процесс.
Также важен тип металла, с которым взаимодействует кислота. Некоторые металлы реагируют с кислотой быстрее и интенсивнее, чем другие. Например, реакция с металлами активных групп, таких как алюминий и цинк, происходит более быстро, чем с металлами нобелевой группы, такими как золото и платина.
Температура также оказывает влияние на скорость реакции кислоты с металлами. При повышении температуры молекулы кислоты и металла движутся быстрее, что способствует более интенсивной реакции. Высокая температура также может способствовать повышению энергии активации, что ускоряет протекание реакции.
Наконец, на скорость реакции влияет также концентрация металла. Чем выше концентрация металла, тем больше активных частиц доступно для реакции с кислотой, что увеличивает скорость реакции. Таким образом, концентрация металла играет важную роль в определении скорости протекания реакции с кислотой.
Различия скорости реакции кислоты с разными металлами

Скорость реакции между кислотами и металлами может различаться в зависимости от химических свойств металла и его способности взаимодействовать с кислотой. В результате такой реакции обычно выделяются газы и образуется соответствующая соли кислоты и металла.
Различия скорости реакции зависят от электрохимического потенциала металла, его активности и способности образовывать комплексы с ионами кислоты. Например, активные металлы, такие как натрий или калий, реагируют сильно и быстро с кислотами, в то время как менее активные металлы, например, медь или железо, реагируют медленнее.
Кислота может ускорять или замедлять реакцию в зависимости от своей концентрации и свойств, а также от формы и состояния металла. Например, концентрированные кислоты обычно приводят к более быстрой реакции, чем разбавленные кислоты. Также металлы в виде порошка или в виде тонких листов реагируют быстрее, чем металлы в виде кусков или сплавов.
Реакция кислоты с металлом может быть положительной или отрицательной, в зависимости от специфических химических свойств металла и кислоты. Это означает, что некоторые металлы реагируют с кислотами, образуя ионы металла и соответствующие соли, тогда как для других металлов такая реакция может быть запрещена или ограничена. Например, золото или платина обладают высокой инертностью и они практически не реагируют с кислотами.
В заключение, скорость реакции кислоты с металлами зависит от нескольких факторов: электрохимического потенциала металла, концентрации и свойств кислоты, формы и состояния металла. Изучение этих различий позволяет понять и обосновать химические свойства металлов и кислот, а также применять их в различных промышленных и научных процессах.
Влияние концентрации кислоты на скорость реакции с металлами

Скорость реакции между кислотами и металлами может существенно изменяться при изменении концентрации кислоты. Концентрация кислоты определяет количество свободных ионов, готовых к реакции с металлом. Большее количество ионов ускоряет реакцию, поскольку увеличивается вероятность столкновения ионов с поверхностью металла.
При низкой концентрации кислоты скорость реакции с металлом снижается. Это объясняется тем, что меньшее количество свободных ионов означает меньшую вероятность столкновения ионов с поверхностью металла. Следовательно, реакция будет происходить медленнее и потребуется больше времени для полного разложения металла.
Однако при повышенной концентрации кислоты скорость реакции с металлом может увеличиваться. Это происходит из-за увеличения числа свободных ионов, готовых к взаимодействию с металлом. Большее количество ионов создает больше возможностей для столкновения и взаимодействия с поверхностью металла, что приводит к ускорению реакции.
Изменение концентрации кислоты может оказывать значительное влияние на скорость реакции с металлами. Оптимальная концентрация кислоты может быть найдена путем проведения серии экспериментов с различными концентрациями и оценки скорости реакции. Это позволяет определить оптимальные условия для максимальной эффективности реакции с металлами.
Влияние температуры на скорость реакции металла с кислотой

Температура является важным фактором, оказывающим значительное влияние на скорость реакции металлов с кислотами. Повышение температуры способствует увеличению скорости реакции.
При повышении температуры, молекулы кислоты и металла приобретают большую кинетическую энергию, что приводит к увеличению частоты столкновений между ними. Это ускоряет химическую реакцию и повышает скорость образования продуктов.
Возрастание температуры также обуславливает увеличение средней скорости движения молекул реагентов. Повышение кинетической энергии молекул способствует их более активному перемещению, что повышает вероятность столкновения между металлом и кислотой.
Также следует отметить, что повышение температуры может также изменить активность молекул кислоты, что может способствовать более эффективному взаимодействию с металлом. Увеличение температуры может привести к изменению структуры кислоты или ее свойств, что сказывается на химической реакции с металлом.
Однако стоит отметить, что при очень высоких температурах могут происходить и другие процессы, такие как выпаривание кислоты или разрушение металла, которые могут снизить скорость реакции. Поэтому, оптимальная температура для реакции металла с кислотой может зависеть от конкретной системы и должна быть определена экспериментально.
Реакции кислот с металлами и их промышленное применение
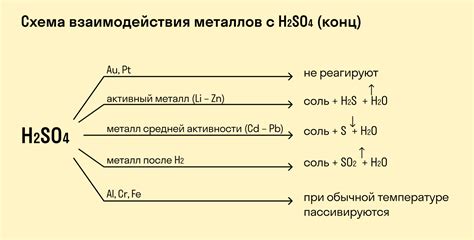
Реакции кислот с металлами
Реакции кислот с металлами являются важными процессами, которые широко используются в промышленности. Они основаны на обмене протонами между кислотой и металлом. При взаимодействии кислоты с металлом образуются соли и выделяется водород. Эти реакции могут быть использованы в различных технологических процессах.
Промышленное применение
Реакции кислот с металлами имеют широкое применение в различных отраслях промышленности. Например, в металлургии кислоты используются для очистки металлов от оксидов и других примесей. Черные металлы, такие как железо и сталь, подвергаются процессу гальванизации, где на поверхность металла наносятся слои других металлов с помощью реакции кислоты с металлом.
Использование соляной кислоты
Соляная кислота является одной из самых распространенных кислот, которая используется в промышленности. Ее реакция с металлами широко применяется для очистки, покрытия и травления различных материалов. Соляная кислота также используется в процессах синтеза, производстве удобрений и пластиков.
Использование серной кислоты
Серная кислота используется в различных отраслях промышленности, включая химическую, нефтяную и угольную. Ее реакция с металлами обеспечивает получение растворов солей, которые используются как катализаторы и хелатирующие агенты. Серная кислота также используется при производстве удобрений, в процессах очистки и оксидации.
Итоги
Реакции кислот с металлами играют важную роль в промышленности. Они позволяют получать соли металлов, очищать и покрывать различные материалы, а также проводить синтез и окисление. Использование кислот в промышленных процессах позволяет достичь высокой эффективности и качества продукции.
Опасность и безопасность взаимодействия кислоты с металлами
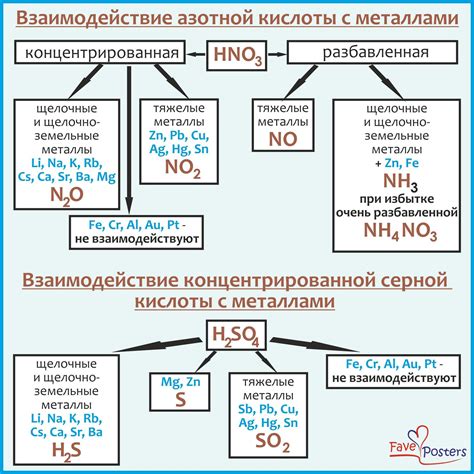
Взаимодействие кислоты с металлами может быть опасным и требует соблюдения мер предосторожности. Во время таких реакций выделяются газы, которые могут быть ядовитыми или взрывоопасными. Поэтому необходимо проводить эксперименты в хорошо проветриваемой области или в специальном оборудовании, обеспечивающем адекватную вентиляцию.
Кроме токсичных газов, при взаимодействии кислоты с определенными металлами может возникать пожароопасность. Некоторые металлы выделяются в виде горючих пар, которые могут образовывать взрывоопасные смеси с воздухом. Поэтому необходимо быть очень осторожными при работе с такими реакциями и соблюдать все меры безопасности.
Еще одной опасностью может быть возникновение образования кислотных паров при взаимодействии кислоты с металлом. Кислотные пары могут вызывать раздражение дыхательных путей и кожи. Поэтому при работе с кислотами необходимо использовать специальные защитные очки, перчатки и маску, чтобы избежать контакта с такими веществами и предотвратить возможные отравления или ожоги.
Для безопасной работы с кислотами и металлами также необходимо знать их особенности и реагировать в соответствии с ними. Реакцию можно сделать более безопасной, добавив воду, постепенно сбрасывать кислоту в металл или регулировать температуру реакции. Важно также иметь четкое представление о том, какие металлы могут использоваться с конкретной кислотой, чтобы избежать неожиданных реакций и возможных опасностей.
Практические применения реакции металлов с кислотами в повседневной жизни
Реакция металлов с кислотами имеет множество практических применений в повседневной жизни. Одним из них является использование этой реакции для очистки домашних предметов. Например, когда на поверхности металлической кастрюли или сковородки образуется слой окиси или неприятных загрязнений, его можно с легкостью удалить, просто подействовав на него кислотой.
Кроме того, реакция металлов с кислотами может быть использована для устранения коррозии. Коррозия металлических поверхностей является распространенной проблемой, особенно в условиях повышенной влажности или воздействия агрессивных сред. Для борьбы с этой проблемой можно применить реакцию металлов с кислотами, которая позволяет удалить слой коррозии и защитить поверхность от дальнейшего разрушения.
Кроме того, реакция металлов с кислотами может быть применена для производства водорода. Водород широко используется в промышленности, например, для производства аммиака или метанола. Реакция металлов с кислотами может быть использована для получения водорода посредством разложения воды на молекулы кислорода и водорода.
Также, реакция металлов с кислотами может быть использована в химическом анализе. Например, достаточно часто для определения содержания металла в растворе применяют метод титрации, основанный на реакции металла с избытком кислоты. По изменению ее концентрации можно определить количество металла в растворе с высокой точностью.
Вопрос-ответ

Какие металлы реагируют с кислотой?
Многие металлы могут реагировать с кислотами, включая цинк, железо, алюминий, медь и другие. Реакция может варьироваться в зависимости от типа кислоты и металла.
Какая роль играет кислота в ходе реакции с металлом?
Кислота является агентом окисления в реакции с металлом. Она отдаёт свои протоны металлу, при этом сама претерпевает восстановление. Это позволяет металлу совершать окислительное восстановительную реакцию, при которой он переходит в положительное окислительное состояние.
