Взаимодействие активных металлов с кислотами является одним из важных физико-химических процессов. Это происходит за счет образования солей и выделения водорода. Такие реакции часто используются в химических лабораториях для получения нужных соединений или как источник водорода.
Уравнение реакции между активным металлом и кислотой можно представить в следующем виде:
Металл + Кислота → Соль + Водород
В качестве активных металлов могут выступать, например, натрий, калий или магний. Кислоты могут быть органическими или неорганическими соединениями, такими как серная, азотная или хлороводородная кислоты.
При взаимодействии металла с кислотой происходит окислительно-восстановительная реакция, в результате которой металл окисляется, а кислота восстанавливается. Образующиеся соли могут быть растворимыми или нерастворимыми в воде, в зависимости от свойств конкретного соединения.
Реакция активных металлов с кислотами: основные принципы

Реакция активных металлов с кислотами – это химический процесс, при котором активные металлы, такие как натрий, калий или магний, вступают во взаимодействие с различными кислотами, образуя соли и выделяя водород.
Взаимодействие активных металлов с кислотами является редокс-реакцией, то есть процессом переноса электронов. При этом активный металл, отдавая электроны, окисляется, а водородные ионы, принимая электроны, восстанавливаются. Реакция происходит при наличии воды, которая является растворителем для кислот и облегчает протекание реакции.
Химическое уравнение реакции активного металла с кислотой обычно записывается следующим образом: активный металл + кислота -> соль + водород. Например, натрий + серная кислота -> сульфат натрия + водород.
В результате реакции образуется соль – соединение, состоящее из катиона металла и аниона кислоты, а также выделяется водородный газ, который можно обнаружить с помощью специальных испытаний. Кроме того, при реакциях активных металлов с некоторыми кислотами может выделяться тепло.
Реакция активных металлов с кислотами широко применяется в различных областях химии, например, в процессе получения солей и водорода, а также в аналитической химии для определения активных металлов и кислот.
Определение активных металлов и кислот
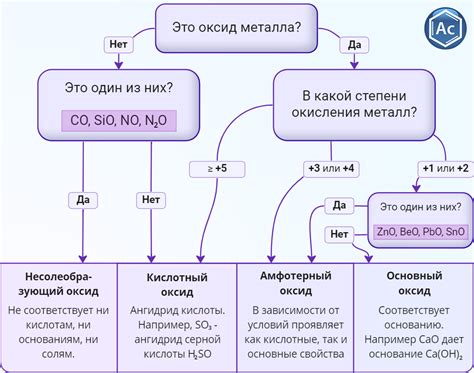
Активные металлы - это элементы, которые легко реагируют с другими веществами, включая кислоты. Они относятся к первым группам периодической системы, таким как щелочные металлы (например, натрий и калий) и щелочноземельные металлы (например, магний и кальций).
Кислоты - это вещества, которые могут отдавать протоны (H+) при реакции. Они обычно имеют кислотный вкус и могут вызывать раздражение при контакте с кожей. Примеры кислот включают соляную кислоту (HCl), серную кислоту (H2SO4) и уксусную кислоту (CH3COOH).
Реакция взаимодействия активных металлов с кислотами может проходить по следующему сценарию: активный металл отдает электроны и образует положительный ион, а кислота принимает эти электроны и образует отрицательный ион. Образовавшийся ион активного металла реагирует с отрицательным ионом кислоты, образуя соль и выделяя водород. Например, реакция между натрием (Na) и соляной кислотой (HCl) приводит к образованию хлорида натрия (NaCl) и выделению молекулярного водорода (H2).
Процесс взаимодействия активных металлов с кислотами

Взаимодействие активных металлов с кислотами – это химический процесс, в результате которого образуется соль и выделяется водород. Данная реакция является типичным примером обменной реакции, которая происходит между металлом и кислотой.
Активные металлы, такие как натрий, калий, цинк и алюминий, имеют высокое восстановительное действие и активно реагируют с кислотами. Кислоты, в свою очередь, относятся к классу веществ, способных отдавать протоны. При контакте активного металла с кислотой происходит образование ионов металла и ионов водорода.
Уравнение реакции взаимодействия активного металла с кислотой имеет общий вид: металл + кислота → соль + водород. Например, при взаимодействии натрия с соляной кислотой возникает хлорид натрия и выделяется водород. Уравнение данной реакции выглядит следующим образом: 2Na + 2HCl → 2NaCl + H2.
Взаимодействие активных металлов с кислотами является важной и широко применяемой реакцией в химии. Она используется для получения солей и водорода, а также для аналитических исследований и синтеза органических и неорганических соединений.
Образование соли и выделение водорода

В процессе взаимодействия активных металлов с кислотами происходит образование соли активного металла и выделение водорода. Данный процесс является редокс-реакцией, при которой активный металл окисляется, а водород иносущественно образуется в редуцированном состоянии.
Образование соли происходит за счет реакции между ионами активного металла и ионами кислоты. При этом ионы активного металла переходят в раствор, образуя растворимую соль, а ионы кислоты также присутствуют в растворе. Образование соли активного металла является основной химической реакцией в данном процессе.
Выделение водорода происходит благодаря более высокой реакционной активности активных металлов по сравнению с водородом. Активный металл получает электроны от кислоты и превращается в положительно заряженные ионы, в то время как водород ионы принимают электроны и превращаются в элементарный водород (H2). В результате реакции водород выделяется в виде газа.
Примеры реакций активных металлов и кислот
Активные металлы обладают высокой реакционной способностью и легко взаимодействуют с кислотами. Реакция активных металлов с кислотами является классическим примером окислительно-восстановительного взаимодействия.
Одним из примеров реакций активных металлов и кислот является реакция металла натрия с серной кислотой. В результате этой реакции образуется соль натрия и сероводород (H2S), который является характерным признаком реакции металла с кислотой.
Еще одним примером реакции активного металла с кислотой является реакция цинка с соляной кислотой. В результате этой реакции образуется соль цинка и водород. Водород испаряется, поэтому реакцию можно наблюдать по появлению пузырьков газа и по характерному звуку, возникающему при их выходе.
Другим примером реакции активного металла с кислотой является реакция алюминия с соляной кислотой. В результате этой реакции образуется соль алюминия и водород. Особенностью этой реакции является то, что алюминий вначале непроизводителен к соляной кислоте из-за его защитной оксидной пленки, но после ее разрушения он начинает активно реагировать с кислотой.
Уравнение реакции взаимодействия активных металлов с кислотами
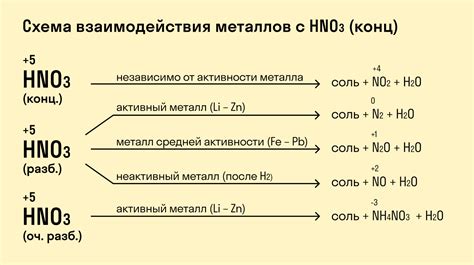
Взаимодействие активных металлов с кислотами является одним из основных проявлений химических реакций. При этом образуются соли и выделяется водород. Уравнение реакции может быть представлено следующим образом:
Металл + Кислота → Соль + Водород
Например, реакция меди с соляной кислотой выглядит так:
2Cu + 4HCl → 2CuCl2 + 2H2
В данном случае, медь (Cu) взаимодействует с соляной кислотой (HCl), образуя соль меди(II) хлорида (CuCl2) и выделяясь водород (H2).
Уравнение реакции взаимодействия активных металлов с кислотами позволяет предсказать продукты реакции и описать ее химический механизм. Это важно для понимания и использования данных реакций в практических целях, например, в химическом анализе и синтезе веществ.
При проведении данной реакции необходимо учитывать, что некоторые активные металлы, такие как натрий, калий и литий, могут быть слишком реакционными и вызывать интенсивное выделение водорода или даже взрывы. Поэтому при работе с кислотами и активными металлами необходимо соблюдать меры предосторожности и работать в специально оборудованных лабораториях или под руководством опытного специалиста.
Общий вид уравнения реакции

Реакция взаимодействия активных металлов с кислотами может быть описана общим видом уравнения. Данная реакция представляет собой неконтролируемое окислительно-восстановительное взаимодействие металла с кислотой.
Уравнение реакции обычно имеет вид:
- Металл + Кислота → Соль + Водород.
В данном уравнении металл обычно выступает в роли восстановителя, а кислота - в роли окислителя. Металл окисляется, теряя электроны, а кислота восстанавливается, получая электроны.
Примером такой реакции может служить реакция взаимодействия цинка с соляной кислотой:
- Цинк + Соляная кислота → Хлорид цинка + Водород.
В данной реакции цинк выступает в роли восстановителя, а соляная кислота - в роли окислителя. Цинк окисляется, теряя электроны и образуя хлорид цинка, а соляная кислота восстанавливается, получая электроны и образуя водород.
Вопрос-ответ

Каково уравнение реакции взаимодействия активных металлов с кислотами?
Уравнение реакции взаимодействия активных металлов с кислотами имеет вид: металл + кислота -> соль + водород.
Какие металлы считаются активными и каковы примеры таких металлов?
К активным металлам относятся металлы, которые способны активно реагировать с кислотами. Примерами активных металлов являются натрий, калий, кальций, магний и алюминий.
Что происходит при реакции активных металлов с кислотами?
При реакции активных металлов с кислотами происходит образование соли и выделение водорода. Металл активно вступает в реакцию с кислотой, образуя ион металла, а кислота отдает протон и образует ион гидроксидного радикала. Соль образуется в результате соединения иона металла и иона гидроксидного радикала, а водород выделяется в свободном состоянии.
Какие факторы могут влиять на скорость реакции взаимодействия активных металлов с кислотами?
Скорость реакции взаимодействия активных металлов с кислотами может зависеть от таких факторов, как концентрация кислоты, температура, поверхность металла, наличие катализаторов и механическое перемешивание. Высокая концентрация кислоты и повышенная температура могут увеличить скорость реакции, а использование катализаторов или механическое перемешивание могут ускорять процесс.
