Взаимодействие кислот с оксидами металлов является одной из важных тем в химии. Кислоты проявляют свойства обычных протонных доноров, а оксиды металлов – основы, действующие как протонные акцепторы. При взаимодействии между ними происходит образование солей и воды. Этот процесс является одним из основных методов получения солей.
Выводы, полученные при изучении взаимодействия кислот с оксидами металлов, имеют важное практическое значение в различных областях науки и промышленности. Они позволяют оптимизировать процессы получения солей, используемых в лекарствах, косметике, бытовой химии и других сферах. Благодаря этим исследованиям были сделаны выводы о важности правильной дозировки и сочетания кислот и оксидов металлов для получения желаемого продукта с заданными свойствами.
Взаимодействие кислот с оксидами металлов не только позволяет получать нужные соединения, но и имеет свои последствия. В частности, оно может приводить к образованию отходов, которые требуют специального обращения. Кроме того, оно может сопровождаться выделением тепла и газов, что влияет на условия проведения реакции и безопасность процесса. Поэтому, важно учитывать все эти аспекты при проектировании и проведении химических реакций, связанных с взаимодействием кислот с оксидами металлов.
Реакция оксидов металлов с кислотами
Взаимодействие оксидов металлов с кислотами является важным процессом в химии. При контакте оксида металла с кислотой, происходит химическая реакция, в результате которой образуются соль и вода.
Оксиды металлов могут быть кислотными, основными или амфотерными. Кислотные оксиды обычно реагируют с щелочными кислотами, такими как соляная кислота или серная кислота. При этом образуется соль и вода. Например, оксид меди(II) реагирует с соляной кислотой, образуя хлорид меди(II) и воду:
- Оксид меди(II) + соляная кислота -> хлорид меди(II) + вода
Основные оксиды металлов реагируют с кислотами, образуя соль и воду. Например, оксид кальция реагирует с серной кислотой, образуя сернокислый кальций и воду:
- Оксид кальция + серная кислота -> сернокислый кальций + вода
Амфотерные оксиды металлов могут реагировать как с кислотами, так и с щелочами. Например, оксид алюминия реагирует с соляной кислотой, образуя соль и воду, а также с щелочным раствором, образуя алюминиевый гидроксид и воду:
- Оксид алюминия + соляная кислота -> хлорид алюминия + вода
- Оксид алюминия + щелочной раствор -> алюминиевый гидроксид + вода
Таким образом, реакция оксидов металлов с кислотами приводит к образованию солей и воды, что является важным процессом в химических реакциях и имеет значительное практическое применение.
Образование солей при взаимодействии кислот с оксидами
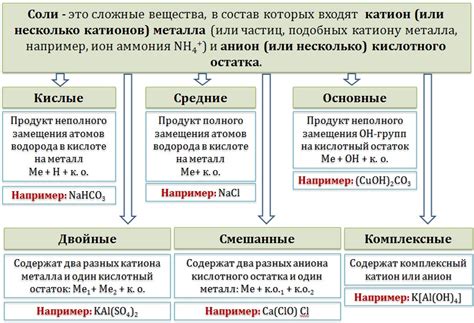
Соли – это химические соединения, образующиеся при взаимодействии кислот с оксидами металлов. Это реакции, которые широко используются в промышленности и повседневной жизни, и имеют большое значение в химии.
Кислоты и оксиды металлов реагируют между собой, образуя соли и воду. Эта реакция называется нейтрализацией. Кислота передает ион водорода H+ оксиду металла, а затем их ионы сливаются вместе, образуя молекулы воды (H2O).
Образование солей при взаимодействии кислот с оксидами зависит от свойств каждого компонента. Оксиды металлов могут быть щелочными, нейтральными или кислыми. Кислоты также бывают различных типов - сильные, слабые или кислотные.
В результате взаимодействия щелочных оксидов со сильными кислотами образуются соли с щелочными реакциями, например, оксид натрия (Na2O) реагирует с соляной кислотой (HCl), образуя соль - хлорид натрия (NaCl).
Слабые оксиды металлов, такие как оксид магния (MgO), реагируют с слабыми кислотами, такими как уксусная кислота (CH3COOH), образуя соли с нейтральными реакциями.
Таким образом, взаимодействие кислот с оксидами металлов приводит к образованию различных солей в зависимости от их свойств. Эти реакции являются основой для понимания химических процессов, которые происходят в природе и в нашей жизни.
Изменение pH в растворах после реакции

Взаимодействие кислот с оксидами металлов приводит к образованию солей и изменению pH раствора. Реакция протекает с образованием воды и оснований, что приводит к увеличению pH раствора.
Водородные кислоты, такие как соляная кислота или серная кислота, реагируют с основными оксидами металлов, например, оксидом натрия или оксидом кальция. В результате образуются соли и вода. При этом происходит переход водородных ионов из кислоты на основание, что приводит к снижению концентрации водородных ионов и повышению pH раствора.
Например, реакция между соляной кислотой и оксидом натрия выглядит следующим образом:
- Na2O + 2HCl → 2NaCl + H2O
В процессе данной реакции водородные ионы из соляной кислоты образуют воду, а натриевые ионы соляной кислоты образуют соль. Это приводит к повышению pH раствора после реакции.
Таким образом, взаимодействие кислот с оксидами металлов влияет на pH раствора. Реакция протекает с образованием солей и воды, что приводит к повышению pH и образованию оснований в растворе.
Химические свойства образовавшихся солей

Образование солей является результатом реакции образования кислоты с оксидом металла. В результате этой реакции образуются соли – химические соединения, состоящие из положительных ионов металла и отрицательных ионов кислоты.
Соли в растворе обладают свойствами электролитов, то есть они разлагаются на положительные и отрицательные ионы и способны проводить электрический ток. Это обуславливает их способность образовывать растворы с характерными свойствами, такими как электролитическая проводимость и способность ионного обмена.
Реактивность солей зависит от свойств ионов, составляющих соль. Некоторые соли обладают кислотными свойствами и способны образовывать кислоты при реакции с водой. Другие соли могут быть основаниями и давать щелочные растворы. В зависимости от состава ионов, соли могут проявлять различные реакции на другие вещества и изменять свои свойства.
Соли как катализаторы могут обладать катализирующими свойствами и ускорять химические реакции. Они могут действовать как активные центры реакции и участвовать в образовании промежуточных стадий реакционного механизма. Катализаторы способствуют повышению скорости химических реакций без изменения своей структуры.
Соли и изменение pH. В зависимости от ионного состава, соли могут повышать или понижать pH раствора. Некоторые соли обладают кислотными свойствами и могут снижать pH, а другие – щелочными свойствами и могут повышать pH. Это связано с ионизацией солей в водном растворе и образованием кислоты или щелочи.
Влияние взаимодействия кислот с оксидами металлов на окружающую среду

Взаимодействие кислот с оксидами металлов имеет значительное влияние на окружающую среду. При контакте с влажностью воздуха оксиды металлов превращаются в кислоты, которые могут попасть в почву, воду и воздух.
Это взаимодействие может привести к серьезным последствиям для окружающей среды. В частности, кислотные осадки, образующиеся в результате этого процесса, могут загрязнять водные ресурсы и влиять на здоровье растений и животных.
Воздействие кислотных осадков на почву может вызывать ее кислотификацию, что может привести к снижению урожайности и разрушению почвенной экосистемы. Кроме того, кислотные вещества могут выщелачивать тяжелые металлы из почвы, что может привести к загрязнению питьевой воды и могут негативно влиять на здоровье людей при употреблении такой воды.
Также, взаимодействие кислот с оксидами металлов может вызывать атмосферное загрязнение. Кислотные газы, попадая в воздух, могут вызывать смог и озоновые дыры, а также влиять на здоровье людей при вдыхании такого воздуха.
В целом, влияние взаимодействия кислот с оксидами металлов на окружающую среду является серьезной проблемой, требующей внимания и принятия соответствующих мер для минимизации его негативного воздействия. Это может включать контроль выбросов кислотных газов, обработку сточных вод и разработку эффективных методов утилизации и переработки отходов, содержащих оксиды металлов.
Применение реакции оксидов с кислотами в промышленности
Реакция оксидов с кислотами является важным процессом в промышленности, который находит применение в различных отраслях. Одним из основных направлений использования этой реакции является получение солей металлов.
В процессе промышленного производства нужно произвести большое количество солей металлов для использования в различных отраслях. Для этого используется реакция оксидов с кислотами, которая позволяет получить соли металлов различной степени окисления. Процесс производства солей металлов основан на выборе оптимального соотношения оксида металла и кислоты, а также на контроле температуры и других условий реакции. Полученные соли металлов могут использоваться в производстве лекарств, красителей, удобрений и многих других продуктов.
Реакция оксидов с кислотами также используется в процессе очистки промышленных стоков. Оксиды металлов, образующиеся в результате производства, могут быть токсичными и опасными для окружающей среды. Для их нейтрализации используются кислоты, которые реагируют с оксидами металлов и образуют нерастворимые соли. Эти соли могут быть удалены из сточных вод, что позволяет очистить их и снизить вредные воздействия на окружающую среду.
Реакция оксидов с кислотами также находит применение в процессе производства электрических элементов и аккумуляторов. Оксиды металлов являются одним из важнейших компонентов электродов, а кислоты служат для нейтрализации и регулирования pH растворов. Контролируя процесс реакции оксидов с кислотами, можно получать электрические элементы с определенными характеристиками и повышенной энергоемкостью.
Вопрос-ответ

Какие выводы можно сделать по поводу взаимодействия кислот с оксидами металлов?
При взаимодействии кислот с оксидами металлов образуются соли и вода. Кислоты обладают свойством донорного действия, то есть они отдают протон (H+) оксиду металла, который, в свою очередь, обладает свойством акцепторного действия и принимает протон. В результате образуется соль металла и вода.
Какие последствия может иметь взаимодействие кислот с оксидами металлов?
При взаимодействии кислот с оксидами металлов могут возникать различные последствия. Например, если кислота и оксид металла являются опасными веществами, то данная реакция может привести к образованию вредных продуктов, которые могут быть опасными для здоровья человека или окружающей среды. Кроме того, такие реакции могут быть использованы в химической промышленности для получения солей металлов или других химических веществ.
