Реакция оксидов металлов с кислотами является одним из основных процессов в химии. Оксиды металлов - это химические соединения, состоящие из металлического и кислородного атомов. Кислоты, в свою очередь, представляют собой соединения, содержащие один или несколько водородных атомов, способных отдавать положительные ионы. При взаимодействии оксидов металлов с кислотами происходит химическая реакция, результатом которой являются образование солей и воды.
В процессе реакции оксид металла вступает в контакт с кислотой, что приводит к образованию соли и воды. Соли получаются за счет соединения отрицательно заряженного кислотного остатка и положительно заряженного иона металла. В то время как образованием воды обусловлено соединение водородных атомов с кислородом, находящимся в оксиде металла. Таким образом, при реакции оксидов металлов с кислотами происходит обмен ионами между реагентами, что приводит к изменению их состава и строению.
Реакция оксидов металлов с кислотами имеет широкое применение в промышленности и научных исследованиях. Соли, полученные в результате этой реакции, применяются в производстве различных материалов, включая лекарственные препараты, краски и керамику. Кроме того, реакция оксидов металлов с кислотами играет важную роль в биохимических процессах организма, так как основные металлы являются необходимыми элементами для нормального функционирования клеток.
Таким образом, реакция оксидов металлов с кислотами является важным химическим процессом, который приводит к образованию солей и воды. Эта реакция имеет широкое применение в различных областях и играет ключевую роль в функционировании организмов. Изучение этого процесса позволяет лучше понять основы химии и применить полученные знания в практической деятельности.
Оксиды металлов и их реакция с кислотами
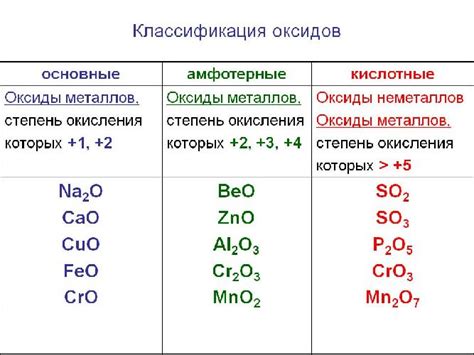
Оксиды металлов – это химические соединения, состоящие из атомов металла и кислорода. Они широко распространены в природе и обладают различными свойствами и применениями. Реакция оксидов металлов с кислотами является одной из основных химических реакций, которая приводит к образованию солей и воды.
Процесс реакции оксидов металлов с кислотами основан на взаимодействии ионов металла и ионов водорода кислоты. В результате этой реакции образуются соли – химические соединения, состоящие из ионов металла и ионов кислоты. Кроме того, образуется вода, которая образуется из ионов водорода и ионов оксида металла.
В реакции оксидов металлов с кислотами происходит нейтрализация – взаимное выравнивание кислотного и основного характера веществ. Оксид металла действует как щелочь, усиливая кислотные свойства кислоты и образуя соль. Реакция оксидов металлов с кислотами рассматривается в рамках теории Бронстеда-Лоу, которая объясняет ее с помощью протонного переноса.
Реакция оксидов металлов с кислотами может протекать с различной интенсивностью в зависимости от характера оксида и кислоты. Некоторые оксиды металлов реагируют с кислотами с большей активностью, образуя соли и воду очень быстро, в то время как другие оксиды металлов могут быть менее активными и реагировать медленнее.
Таким образом, реакция оксидов металлов с кислотами является важным химическим процессом, который приводит к образованию солей и воды. Этот процесс имеет множество применений в различных областях науки, технологии и промышленности, и является объектом изучения в химических курсах и лабораторных работах.
Образование солей посредством реакции оксидов металлов с кислотами

Соли являются важными химическими соединениями, которые образуются при взаимодействии оксидов металлов с кислотами. Эта реакция является основным способом получения солей и широко используется в химической промышленности.
При реакции оксида металла с кислотой происходит кислотное взаимодействие, в результате которого образуется соль и вода. Оксид металла вводит ион металла в реакцию, а кислота - ион водорода. Таким образом, уходят противоположные заряженности и образуется нейтральное соединение - соль.
Реакции образования солей сопровождаются выделением тепла, что является одним из признаков теплового эффекта химической реакции. Причём интенсивность выделения тепла зависит от конкретных условий реакции и специфики взаимодействующих веществ.
Примеры реакций образования солей:
- Оксид алюминия (Al2O3) + серная кислота (H2SO4) = сульфат алюминия(III) (Al2(SO4)3) + вода (H2O);
- Оксид меди(I) (Cu2O) + азотная кислота (HNO3) = нитрат меди(I) (CuNO3) + вода (H2O);
- Оксид кальция (CaO) + соляная кислота (HCl) = хлорид кальция (CaCl2) + вода (H2O).
Таким образом, реакция оксидов металлов с кислотами является важным процессом в химии и имеет множество промышленных применений.
Вода - один из продуктов реакции

При взаимодействии оксидов металлов с кислотами образуется вода, являющаяся одним из основных продуктов реакции. Этот процесс основан на обмене ионами между веществами и происходит с образованием солей металлов.
Вода образуется за счет реакции остаточных ионов в кислоте с ионами оксида металла. В процессе реакции происходит обмен ионами, при котором положительные ионы металла связываются с отрицательными ионами кислоты, образуя соли и освобождая молекулы воды. Таким образом, вода является неотъемлемой частью этой химической реакции.
В результате образования воды реакции оксидов металлов с кислотами проходят с выделением тепла. Это объясняется изменением энергии и связей веществ в процессе превращения оксидов металлов и кислоты в соли и воду. При этом, кислота выступает в роли протонного донора, отдавая свой протон оксиду металла, а затем происходит образование воды и солей.
Образование воды в реакции оксидов металлов с кислотами является основным физическим и химическим процессом, который имеет большое значение в химии. Поэтому изучение этого процесса позволяет лучше понять взаимодействие между оксидами металлов и кислотами, а также применить полученные знания в различных областях, включая технологические и промышленные процессы.
Особенности взаимодействия различных оксидов металлов с кислотами
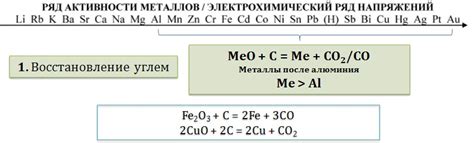
Оксиды металлов, взаимодействуя с кислотами, образуют соли и воду. Однако процесс реакции может иметь отличия в зависимости от характера оксида металла и кислоты.
Кислоты сильные и слабые. Взаимодействие оксида металла с сильной кислотой происходит с образованием соли и воды. При этом кислота диссоциирует полностью, а ион металла реагирует с отрицательным ионом кислоты.
Реакция оксидов металлов и слабых кислот может быть не полной. Это связано с тем, что слабые кислоты диссоциируют только частично, поэтому оксид металла может не полностью реагировать с присутствующими ионами кислоты.
Оксиды металлов могут быть разделены на кислые, основные и нейтральные в зависимости от их реакционной способности. Кислые оксиды реагируют с щелочами, образуя соли и воду. Основные оксиды реагируют с кислотами, также образуя соли и воду. Нейтральные оксиды образуют соли только при взаимодействии с соответствующей кислотой.
Оксид железа, например, реагирует с различными кислотами по-разному. Он образует соль и воду при взаимодействии с сильными кислотами, такими как серная или хлороводородная. Слабые кислоты, например, уксусная или фосфорная, не могут полностью растворить оксид железа и образовать соль.
Вопрос-ответ

Каким образом происходит реакция оксидов металлов с кислотами?
Реакция оксидов металлов с кислотами происходит путем образования солей и воды. Металлический оксид реагирует с кислотой, образуя соль и воду. В результате этой химической реакции происходит увеличение числа ионов в растворе, что приводит к изменению его свойств.
Какова роль оксидов металлов в реакции с кислотой?
Оксиды металлов выполняют роль оснований в реакции с кислотами. Они сопоставимы с щелочами, так как способны давать ионы гидроксида (OH-). При взаимодействии оксида металла и кислоты происходит образование солей и воды.
Можно ли использовать все оксиды металлов для реакции с кислотами?
Не все оксиды металлов могут реагировать с кислотами. Для того чтобы оксид металла смог реагировать с кислотой, его химическая активность должна быть достаточно высокой. Некоторые оксиды металлов, такие как оксид алюминия (Al2O3) или оксид железа (Fe2O3), не реагируют с кислотами и не образуют солей и воды.
Какие свойства могут измениться в растворе после реакции оксида металла с кислотой?
Реакция оксида металла с кислотой приводит к изменению свойств раствора. Образующиеся при реакции соли могут изменить рН раствора, что повлияет на его кислотно-щелочной характер. Также может измениться электропроводность раствора и возникнуть отдельные вещества, которые могут оказывать влияние на другие процессы.
