Оксиды металлов представляют собой соединения металлов с кислородом. В природе они широко распространены и встречаются в виде минералов и руд. Взаимодействие оксидов металлов с кислотами является одной из основных реакций в химии и имеет большое значение как в научных исследованиях, так и в промышленности.
Существует несколько видов оксидов металлов, которые могут взаимодействовать с кислотами. Например, неполярные оксиды металлов, такие как оксиды магния или цинка, обладают слабыми кислотными свойствами и не реагируют с большинством кислот. Однако кислоты сильных оксоанионов, такие как серная или хлорная, могут реагировать с неполярными оксидами металлов и образовывать соли или другие соединения.
Полярные оксиды металлов, такие как оксиды алюминия или железа, обладают более выраженными кислотными свойствами и реагируют с большинством кислот. Взаимодействие таких оксидов с кислотами может приводить к образованию солей, гидроксидов или соединений с другими кислотными радикалами.
Взаимодействие оксидов металлов с кислотами является основой для получения ряда важных веществ, используемых в промышленности и научных исследованиях. Оно также имеет большое значение в биологии, так как большинство биологических систем содержат металлы и взаимодействуют с оксидами металлов. Изучение взаимодействия кислот с оксидами металлов позволяет более глубоко понять различные физико-химические и биологические процессы, происходящие в природе и в лаборатории.
Кислоты: свойства и виды
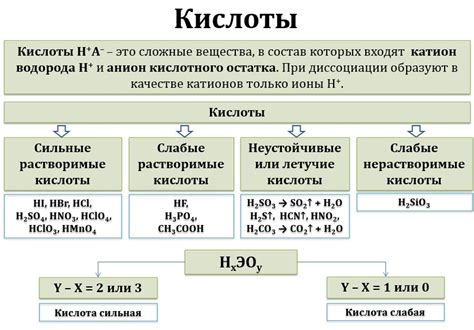
Кислоты - это вещества, которые могут реагировать с основаниями, оксидами и металлами, образуя соли и воду. У кислот есть ряд характерных свойств, таких как кислотность и возможность отдавать протоны.
Свойства кислот определяются их структурой и составом. Они могут быть органическими и неорганическими. Органические кислоты содержат в своей структуре группы карбоксильных -COOH, а неорганические кислоты состоят преимущественно из неорганических соединений.
Среди неорганических кислот наиболее распространены соляная кислота HCl, серная кислота H2SO4 и азотная кислота HNO3. Они широко используются как катализаторы реакций и ингредиенты в процессе производства различных продуктов.
Особую группу кислот составляют оксокислоты, которые образуются в результате соединения кислорода с неорганическими элементами. Такие кислоты имеют сложную структуру и включают такие вещества, как серная кислота H2SO4 и фосфорная кислота H3PO4. Оксокислоты широко применяются в химической промышленности, медицине и других отраслях.
- Кислоты могут быть сильными и слабыми, в зависимости от их способности отдавать протоны.
- Свойства кислот зависят от кислотности раствора.
- Сильные кислоты, такие как серная кислота, могут вызывать ожоги на коже и разрушать металлы.
- Многие кислоты имеют резкий запах и ядовиты для организма.
Оксиды металлов: структура и свойства
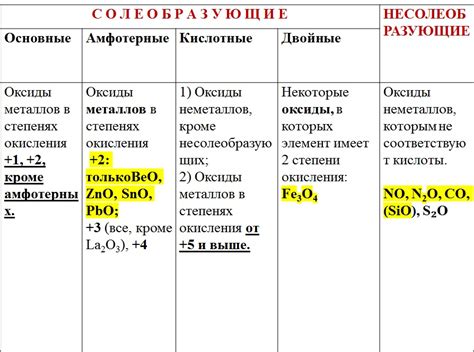
Оксиды металлов представляют собой химические соединения, состоящие из металлического элемента и кислорода. Они обладают сложной кристаллической структурой, которая зависит от размеров и заряда ионов металла и кислорода. Так, при малых размерах ионов металла и кислорода образуется структура типа кубической плотной упаковки (КПУ), а при больших размерах формируется структура типа гексагональной ближайшей упаковки (ГБУ).
Важным свойством оксидов металлов является их высокая термическая и химическая устойчивость. Оксиды металлов обладают высокой температурой плавления и кипения, что делает их пригодными для использования в высокотемпературных процессах. Кроме того, они обладают способностью образовывать сильные химические связи с другими веществами, что позволяет им выполнять роль катализаторов и использоваться в различных химических реакциях.
Оксиды металлов также обладают электрическими свойствами. Они могут проявлять как проводимость, так и полупроводимость. Многие оксиды металлов имеют металлический тип проводимости, то есть обладают способностью передавать электрический ток. Однако, некоторые оксиды металлов, например, оксиды полупроводникового типа, обладают особенной электропроводностью, которая может регулироваться в зависимости от условий окружающей среды.
Выводя свойства оксидов металлов на практику, можно сказать, что они широко используются в различных отраслях промышленности. Они являются важными компонентами в процессе производства металлических сплавов, катализаторов, полупроводников и керамических материалов. Благодаря своим химическим и физическим свойствам, оксиды металлов играют значительную роль в современных технологиях и способствуют развитию науки и техники.
Процесс взаимодействия кислот с оксидами металлов

Взаимодействие кислот с оксидами металлов — это химический процесс, который приводит к образованию солей и воды. Оксиды металлов, будучи основаниями, реагируют с кислотами, которые являются кислотами Бренштеда — Лоури. Наиболее известный пример такой реакции — реакция оксида натрия с серной кислотой.
В результате взаимодействия оксида натрия (Na2O) с серной кислотой (H2SO4) образуется натрийсульфат (Na2SO4) и вода (H2O). Реакция протекает по следующему уравнению:
Na2O + H2SO4 → Na2SO4 + H2O
Взаимодействие кислот с оксидами металлов проводится в растворе или в плавленом состоянии. Осуществляется оно путем простого смешивания компонентов и образования продуктов реакции. Результаты таких реакций могут быть использованы в различных технологических и промышленных процессах.
Значительную роль в взаимодействии кислот с оксидами металлов играют реакция протекающая между активным металлом и кислотой. В результате такой реакции образуется соответствующий соль и водород. Например, реакция между металлическим натрием и соляной кислотой приводит к образованию хлорида натрия и выделению молекулярного водорода.
2Na + 2HCl → 2NaCl + H2
Таким образом, взаимодействие кислот с оксидами металлов — это важный процесс, который находит свое применение в различных областях науки, техники и промышленности.
Практическое применение взаимодействия кислот с оксидами металлов

Взаимодействие кислот с оксидами металлов имеет широкое практическое применение в различных областях науки и технологий. Оно играет важную роль в процессах производства и получения различных веществ, а также в создании специальных материалов.
Одним из основных применений взаимодействия кислот с оксидами металлов является получение солей. Кислоты реагируют с оксидами металлов, образуя соли, которые могут иметь разнообразные свойства и применения. Соли широко используются в химической промышленности, фармацевтике, пищевой промышленности и других отраслях.
Кроме того, взаимодействие кислот с оксидами металлов можно использовать для получения кислорода или других газов. Например, растворение оксидов металлов в кислотах может приводить к выделению кислорода, который может быть использован в различных процессах, включая оксидацию и сгорание. Это является важным процессом в химической промышленности и применяется в производстве различных веществ и материалов.
Также взаимодействие кислот с оксидами металлов может применяться для очистки отходов и удаления загрязнений. Некоторые оксиды металлов являются токсичными или опасными веществами и требуют специальной обработки перед утилизацией. Кислоты могут реагировать с такими оксидами, образуя менее опасные соединения или растворы, которые могут быть легко обработаны и утилизированы в безопасной форме.
В целом, взаимодействие кислот с оксидами металлов является важным и полезным процессом, который находит широкое применение в различных сферах науки и промышленности. Оно позволяет получать различные вещества и материалы, улучшать технологические процессы и обеспечивать безопасную обработку отходов.
Вопрос-ответ

Какие кислоты взаимодействуют с оксидами металлов?
Различные кислоты могут взаимодействовать с оксидами металлов. Например, сульфидная кислота (H2S) может реагировать с оксидом железа (FeO), образуя сульфид железа (FeS). Соляная кислота (HCl) может взаимодействовать с оксидом меди (CuO), образуя хлорид меди (CuCl2). Кроме того, есть и другие кислоты, которые могут реагировать с оксидами металлов в зависимости от условий и конкретных соединений.
Как происходит взаимодействие кислот с оксидами металлов?
Взаимодействие кислот с оксидами металлов обычно происходит по принципу кислотно-основного реагирования. Кислота отдаёт протон (H+) оксиду металла, образуя воду (H2O), а сам оксид превращается в соль. Например, соляная кислота (HCl) реагирует с оксидом меди (CuO) следующим образом: HCl + CuO → CuCl2 + H2O. Это реакция с образованием хлорида меди и воды.
Можно ли использовать взаимодействие кислот с оксидами металлов в промышленности?
Да, взаимодействие кислот с оксидами металлов используется в промышленности для различных целей. Например, реакция соляной кислоты с оксидом алюминия (Al2O3) позволяет получить хлорид алюминия, который используется в производстве фармацевтических препаратов и алюминиевых сплавов. Также, взаимодействие кислоты с оксидами металлов может использоваться для удаления остатков оксидов металлов с поверхностей изделий и оборудования.
