Взаимодействие кислот с металлами является одной из важнейших химических реакций. Кислоты – это соединения, которые в водном растворе образуют положительные ионы водорода (H+). Металлы, в свою очередь, представляют собой элементы, которые обладают характеристиками, такими как электропроводность и металлический блеск. Однако, все металлы различаются по своей активности и способности реагировать с кислотами.
Металлы классифицируются на активные, пассивные и инертные в зависимости от их способности реагировать с кислотами. Активные металлы, такие как натрий (Na) или калий (K), обладают высокой реакционной способностью и легко реагируют с кислотами, образуя соли и выделяя водород. Такие реакции обычно происходят с выделением тепла и побуждают кислоты к удалению водорода из металла.
С другой стороны, пассивные металлы, такие как железо (Fe) или алюминий (Al), обладают меньшей реакционной способностью и реагируют с кислотами медленнее. Они могут образовывать оксидные пленки, которые препятствуют дальнейшим реакциям с кислотным окружением. Некоторые пассивные металлы, такие как золото (Au) или платина (Pt), вообще почти не реагируют с кислотами и считаются инертными.
Активность металлов и их свойства

Металлы являются одними из наиболее распространенных химических элементов в природе. У них есть различные свойства, которые определяют их активность при взаимодействии с другими веществами. Активность металлов зависит от их электрохимического потенциала, который определяет их способность отдавать или принимать электроны.
У металлов высокой активности, таких как литий, натрий и калий, электрохимический потенциал отрицательный, что означает, что они легко отдают электроны и образуют положительные ионы. Эти металлы очень реактивны, они быстро окисляются воздухом и реагируют с кислотами, образуя соли и выделяя водород.
Металлы средней активности, такие как железо, медь и цинк, имеют средний электрохимический потенциал. Они могут реагировать с некоторыми кислотами, но не так сильно, как металлы высокой активности. Например, железо реагирует с соляной кислотой, образуя соль железа и выделяя водород.
Металлы низкой активности, такие как серебро, золото и платина, имеют высокий электрохимический потенциал. Они не реагируют с кислотами и не окисляются воздухом, поэтому они обладают высокой стойкостью к коррозии. Эти металлы часто используются для изготовления украшений и электронных компонентов.
Взаимодействия кислоты и металла:

Металлы различной активности проявляют различную степень реактивности при взаимодействии с кислотами. Некоторые металлы сильно реагируют с кислотами, выделяя при этом водород, в то время как другие металлы мало или вообще не реагируют.
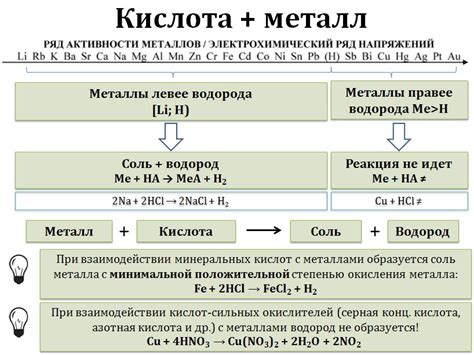
Сильные кислоты такие, как соляная кислота(HCl) или серная кислота (H2SO4) обычно реагируют с активными металлами, такими как натрий (Na) или калий (K). В результате такой реакции между кислотой и металлом образуется соль и выделяется газовый водород (H2).
Например, соляная кислота реагирует с активным металлом цинком (Zn) по следующей схеме: 2HCl + Zn → ZnCl2 + H2. В результате этой реакции образуется хлорид цинка (ZnCl2) и выделяется газовый водород.
Однако, сильные кислоты не реагируют с пассивными металлами, такими как алюминий (Al) или железо (Fe). Это связано с образованием защитной пленки оксида на поверхности металла, которая препятствует дальнейшему взаимодействию с кислотой.
Таким образом, взаимодействие кислоты и металла может протекать с различной степенью реактивности в зависимости от активности металла и типа используемой кислоты.
Реакции с кислотами сильной активности:
Кислоты сильной активности обладают высокой электроотрицательностью и могут образовывать наиболее сильные химические соединения. Взаимодействие таких кислот с металлами происходит с образованием солей и выделением водорода. Эти реакции являются экзотермическими, то есть сопровождаются выделением тепла.
Например, соляная кислота (HCl), являющаяся одной из самых распространенных кислот, реагирует с активными металлами, такими как натрий (Na), калий (K) или магний (Mg), образуя соответствующие соли и выделяя водород.
2HCl + 2Na → 2NaCl + H₂
2HCl + Mg → MgCl₂ + H₂
Серная кислота (H₂SO₄) также относится к сильным кислотам и может реагировать с металлами. Например, реакция серной кислоты с железом (Fe) приводит к образованию соли железа(II) сернокислого (FeSO₄) и выделению водорода:
H₂SO₄ + Fe → FeSO₄ + H₂
В результате взаимодействия сильных кислот с металлами, образуется соль, которая, в зависимости от конкретной реакции, может быть растворимой или нерастворимой в воде.
Реакции с кислотами средней активности:
Кислоты средней активности проявляют более умеренную способность к взаимодействию с металлами по сравнению с сильными кислотами. Однако они также способны вызывать реакции с некоторыми металлами, хотя и в меньшей степени.
- Соляная кислота (HCl) образует растворы, которые могут взаимодействовать с некоторыми металлами, такими как цинк (Zn) и алюминий (Al), причем реакция идет с выделением водорода (H2). Например, при добавлении соляной кислоты к цинку образуется солянокислый цинк (ZnCl2) и выделяется водородный газ.
- Уксусная кислота (CH3COOH) также является кислотой средней активности и способна взаимодействовать с некоторыми металлами. Она реагирует с металлическим алюминием (Al), образуя солянокислый алюминий (Al(CH3COO)3) и выделяя водородный газ.
Взаимодействие кислот с металлами средней активности не так сильное, как с сильными кислотами, но все же они могут вызвать реакции, которые следует учитывать при работе с этими веществами.
Реакции с кислотами слабой активности:
К металлам различной активности относятся и такие, которые проявляют слабую активность в реакции с кислотами. К таким металлам относятся, например, медь (Cu), свинец (Pb), никель (Ni), и др.
Слабая активность металлов в реакции с кислотами обусловлена их низкой реакционной способностью. Поэтому для инициирования реакции требуется большее количество кислоты и/или более высокая концентрация кислоты.
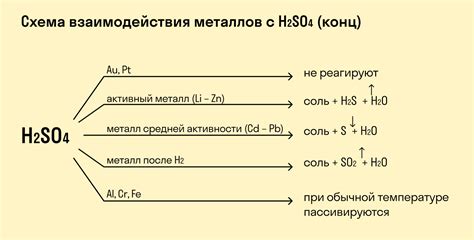
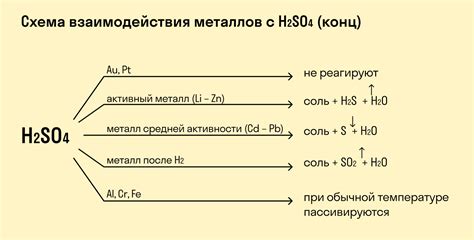
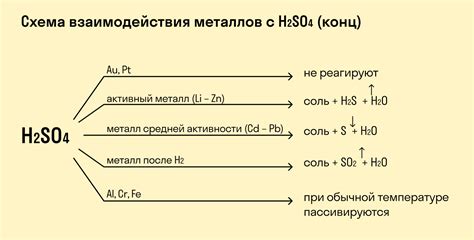
Реакции этих металлов с кислотами протекают с выделением газов, например, водорода. Например, медь при реакции с разбавленной серной кислотой (H2SO4) выделяет водород:
Сu + H2SO4 → CuSO4 + H2↑
Также, никель при реакции с разбавленной соляной кислотой (HCl) выделяет водород:
Ni + 2HCl → NiCl2 + H2↑
Такие реакции следует проводить с осторожностью, так как они могут протекать довольно медленно из-за низкой активности металлов. Для ускорения реакции можно использовать повышенную концентрацию кислоты или нагревание реакционной смеси.
Применение взаимодействий между кислотами и металлами
Взаимодействия между кислотами и металлами находят широкое применение в различных областях науки и техники. Одним из наиболее известных примеров являются реакции, происходящие при производстве водорода. Данная реакция проводится с использованием сильной кислоты, такой как серная или соляная кислота, и активного металла, например, цинка или алюминия. При этом происходит распад кислоты на ионы водорода и соответствующие соли металла. Получаемый в результате водород может быть использован в различных процессах, включая производство электроэнергии или использование в качестве топлива для автомобилей.
Взаимодействия кислот с металлами также используются для производства металлоорганических соединений. Это класс химических соединений, в которых металл связан с органическими группами. Для их получения часто применяются такие кислоты, как уксусная кислота, формирующие комплексы с металлом. Полученные металлоорганические соединения широко применяются в органическом синтезе, катализе реакций и в других областях химии.
Кроме того, взаимодействия кислот с металлами играют важную роль в нанотехнологиях. При проведении реакций с металлами в наномасштабе возникают особые эффекты, связанные с изменением структуры и свойств материалов. Такие эффекты могут быть использованы для создания наночастиц с определенными свойствами, что открывает новые возможности для разработки новых материалов и устройств.
Взаимодействия кислот с металлами также находят применение в пищевой промышленности. Например, лимонная кислота, являющаяся слабой кислотой, используется для консервирования пищевых продуктов и соков. Данный процесс основан на реакции между лимонной кислотой и металлами, при которой образуются соли металла, стабилизирующие продукт и улучшающие его вкусовые качества.
Выводы:

В результате проведенного исследования были получены следующие выводы.
- Металлы различной активности проявляют разную реакцию при взаимодействии с кислотами. Активные металлы, такие как натрий и калий, реагируют сильно с кислотами, выделяя при этом водород и образуя соли.
- Металлы средней активности, такие как медь и цинк, реагируют с кислотами, образуя соли, но процесс происходит менее интенсивно по сравнению с активными металлами.
- Металлы низкой активности, такие как железо и алюминий, обычно не реагируют с кислотами, но некоторые кислоты, например, соляная кислота, могут вызывать их коррозию.
Таким образом, активность металла играет важную роль при взаимодействии с кислотами. Более активные металлы проявляют большую реакцию, образуя соли и выделяя водород, в то время как менее активные металлы реагируют слабо или не реагируют вовсе.
Вопрос-ответ

Какие металлы могут взаимодействовать с кислотами?
С кислотами могут взаимодействовать различные металлы, в зависимости от их активности. Наиболее активные металлы, такие как натрий, калий, магний, реагируют с большинством кислот, включая сильные кислоты, такие как серная и хлористоводородная. Менее активные металлы, такие как цинк, свинец и железо, могут реагировать только с некоторыми кислотами, такими как соляная кислота. Более нобельные металлы, такие как золото и платина, не реагируют с кислотами.
Что происходит при взаимодействии металлов с кислотами?
При взаимодействии металлов с кислотами происходит химическая реакция, называемая реакцией образования соли и выделения водорода. Металлы отдают свои электроны кислоте, образуя положительно заряженные ионы металла, а восстановленные электроны участвуют в образовании молекул водорода. Эта реакция происходит быстрее с активными металлами и сильными кислотами, так как они обладают большей способностью отдавать электроны и принимать электроны соответственно.
Какие факторы влияют на скорость реакции между металлами и кислотами?
На скорость реакции между металлами и кислотами влияют несколько факторов. В первую очередь, активность металла - более активные металлы реагируют быстрее. Также важно концентрация кислоты - чем выше концентрация, тем быстрее происходит реакция. Реакция также может быть ускорена повышением температуры или использованием катализаторов. Реакция может быть замедлена в присутствии ингибиторов или при низкой температуре.
