Химические реакции между кислотами и металлами представляют собой важный класс реакций, которые имеют широкое применение в различных областях науки и промышленности. Кислоты являются реактивами, которые содержат в своем составе водород и могут отдавать его, образуя ионы водорода. Металлы, в свою очередь, могут быть разной природы, их способность реагировать с кислотами определяется их активностью и химическими свойствами.
Основным принципом химических реакций между кислотами и металлами является образование солей и выделение водорода. Когда металл вступает в реакцию с кислотой, происходит обмен ионами: металлический катион замещает обладающую позитивным зарядом водородную катионную группу кислоты, а ион кислорода остается в соли. В результате этой реакции образуются соль и водород, который обычно выделяется в виде пузырьков, вызывая эффект шипения и пузырькования.
Эти реакции имеют практическое применение в различных областях. Одним из наиболее широко используемых методов является гальваническое покрытие металлами. В этом процессе металлы, например, цинк или никель, используются в качестве анода, а изделие, которое требуется покрыть, является катодом. Между ними происходит химическая реакция, в результате которой металл отдает свои ионы и покрывает поверхность катода тонким металлическим слоем. Это позволяет улучшить защитные свойства катода и изменить его внешний вид.
Кроме того, химические реакции между кислотами и металлами используются в процессе очистки металлических поверхностей от окислов и других загрязнений. Кислоты, например, соляная или серная, способны взаимодействовать с окислами и превращать их в водородные ионы. Это позволяет удалить загрязнения с поверхности металла и восстановить его первоначальную блеск и чистоту.
Таким образом, химические реакции между кислотами и металлами являются важным инструментом в химии и промышленности, позволяющим осуществлять различные процессы, связанные с покрытием и очисткой металлических поверхностей. Благодаря этим реакциям можно улучшить защитные свойства металла, изменить его внешний вид и восстановить его первоначальное качество.
Взаимодействие металлов с кислотами: основные принципы

Кислоты – химические соединения, способные диссоциировать в водных растворах, образуя ион гидро́нний H+ и отрицательный анион. Металлы, в свою очередь, обладают способностью активно реагировать с различными веществами, включая кислоты.
Взаимодействие металлов с кислотами основано на процессе обмена ионами: металлический катион вытесняет из раствора гидрогидроний, а активный ион кислоты связывается с металлом, образуя соль и выделяя водород. Такие реакции называются восстановительно-окислительными реакциями, где металл выступает в качестве восстановителя, а кислота – в качестве окислителя.
Скорость реакции между металлом и кислотой зависит от ряда факторов: концентрации раствора, активности металла, температуры и т.д. Некоторые металлы, такие как натрий или калий, реагируют с кислотами более активно, кислота может образовывать газы при взаимодействии с металлом.
Взаимодействие металлов с кислотами находит широкое применение в различных областях. Оно может быть использовано для очистки поверхностей от оксидных пленок, производства водорода, получения солей металлов и проведения химических реакций в лаборатории. Также эта реакция важна в области экологии, например, для нейтрализации опасных отходов и очистки загрязненных вод.
Кислоты и металлы: как происходит химическая реакция?
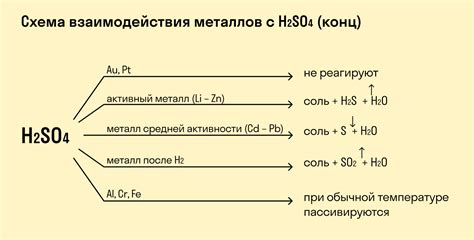
Химическая реакция между кислотами и металлами происходит благодаря взаимодействию ионов обоих веществ. Основным принципом таких реакций является обмен протонами между кислотой и металлом. Кислоты обладают свойством отдавать протоны, образуя положительно заряженные ионы - катионы, а металлы, в свою очередь, обладают способностью принимать протоны, образуя отрицательно заряженные ионы - анионы.
В процессе реакции кислоты и металла, ионы обоих веществ притягиваются друг к другу благодаря электростатическим силам. Кислотный катион и металлический анион образуют ионное соединение или соль. Таким образом, химическая реакция между кислотами и металлами приводит к образованию соли и выделению водорода.
Соли, образующиеся в результате реакции кислоты и металла, имеют важное практическое применение. Они являются основой для производства множества химических веществ и материалов. Например, многие соли используются в качестве удобрений для растений, позволяя им получить необходимые питательные вещества. Кроме того, соли также используются в производстве красителей, стекла, металлов и других веществ.
Важно отметить, что реактивность кислот и металлов различается и зависит от их химических свойств. Некоторые кислоты, такие как соляная кислота или серная кислота, обладают высокой активностью и могут реагировать с широким спектром металлов. В то же время, некоторые металлы, такие как золото или платина, малоактивны и не реагируют с большинством кислот.
Реакции кислот с металлами: примеры и их применение
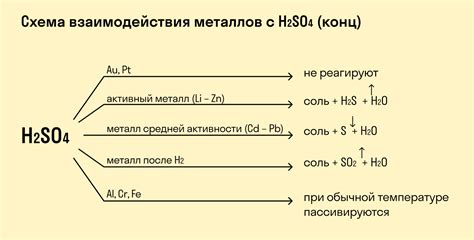
Кислоты – вещества, обладающие кислотными свойствами, включая способность отдавать протоны. Одной из характерных реакций, которые они могут осуществлять, являются реакции с металлами. В результате таких реакций происходит образование солей и выделение водорода. Реакция кислоты с металлом может быть представлена следующим образом: кислота + металл → соль + водород. Примерами реакций кислот с металлами являются реакции соляной кислоты с цинком, серной кислоты с железом и азотной кислоты с медью.
Реакции кислот с металлами находят широкое применение в различных отраслях науки и техники. Например, реакция соляной кислоты с цинком используется в производстве водорода. В действии соляной кислоты на цинк образуется хлорид цинка, а также выделяется водород. Выделение водорода при данной реакции может быть использовано в качестве источника энергии, например, для снабжения портативных устройств.
Реакции с кислотами также играют важную роль в химическом анализе. Например, реакция азотной кислоты с медью применяется для определения содержания аминов в органических соединениях. При этой реакции образуется нитрат меди и выделяется окислительное кислородное соединение.
Реакции кислот с металлами также находят применение в промышленности. Они используются при производстве различных материалов и продуктов. Например, реакция серной кислоты с железом может быть использована для получения серной кислоты. Эта кислота является важным компонентом в производстве удобрений, жидкостей для аккумуляторов и других химических соединений.
Явления и свойства в ходе реакций между кислотами и металлами
1. Образование соли и водорода:
В ходе реакций между кислотами и металлами происходит образование солей и выделение газа – водорода. Соль представляет собой сложное химическое соединение, состоящее из положительно заряженных ионов металла и отрицательно заряженных ионов кислоты. Образующийся водород обычно выделяется в виде пузырьков газа.
2. Чтение закона сохранения массы:
В ходе химической реакции масса реагентов должна быть равна массе продуктов. При взаимодействии кислот с металлами, оба реагента участвуют в реакции и образуют продукты. Масса соли, выделяющейся в результате этой реакции, должна быть равна сумме масс металла и кислоты, которые реагируют между собой.
3. Изменение окраски:
При реакциях между кислотами и металлами иногда наблюдается изменение окраски реагентов или образующихся продуктов. Например, в реакции меди с соляной кислотой образуется зеленовато-синяя соль меди(II) хлорида. Это изменение окраски может быть использовано для определения наличия и количества определенного металла в образце.
4. Эволюция тепла и возгорание:
Некоторые реакции между кислотами и металлами сопровождаются выделением тепла или даже возгоранием. Например, реакция между серной кислотой и металлическими гранулами алюминия протекает с выделением тепла и света. Поэтому при проведении таких реакций необходимо соблюдать меры предосторожности и применятьа необходимые защитные средства.
5. Определение активности металлов:
Реакции между кислотами и металлами могут использоваться для определения активности металлов. Активные металлы, такие как натрий и калий, реагируют с кислотами более активно и интенсивно, чем менее активные металлы, такие как железо или медь. Это свойство может быть использовано для определения активности и различных металлов.
Безопасность и осторожность при работе с кислотами и металлами

Работа с кислотами и металлами требует особой осторожности и соблюдения мер безопасности. Кислоты могут быть коррозивными, едкими и опасными для здоровья, поэтому необходимо использовать соответствующую защитную экипировку, такую как защитные очки, перчатки и фартук.
Перед началом работы следует ознакомиться с правильными методами хранения, перемещения и использования кислот. Кислоты следует хранить в специальных емкостях из материалов, устойчивых к их воздействию, и хранить их в отдельных помещениях или шкафах, отделенных от других химических веществ.
Во время работы необходимо работать в хорошо проветриваемом помещении или под вытяжным шкафом, чтобы избежать ингаляции опасных паров и газов. При необходимости, можно использовать специальные аппараты для очистки воздуха.
При работе с металлами следует учитывать их химические свойства и возможные реакции с кислотами. Некоторые металлы могут образовывать взрывоопасные смеси или выделять токсичные газы при контакте с определенными кислотами. Для предотвращения аварийных ситуаций необходимо быть внимательным и следовать инструкциям по безопасной работе.
При разливе и перемещении кислот и металлов необходимо использовать подходящую посуду и оборудование. Не рекомендуется использовать обычные посуду и инструменты, так как они могут быть не стойкими к химическим воздействиям и легко повредиться. Рекомендуется использовать специализированную кислотоупорную посуду и инструменты.
В случае попадания кислоты на кожу или в глаза необходимо незамедлительно промыть зону попадания большим количеством воды и обратиться за медицинской помощью. Чем быстрее реагировать в случае несчастного случая, тем больше шансов предотвратить серьезные последствия.
При работе с кислотами и металлами всегда имейте под рукой чистую воду, кислотоупорный нейтрализатор и порошок для тушения пожаров класса D. В случае возникновения пожара или аварийной ситуации, можно нейтрализовать опасные вещества или тушить пожар, минимизируя риск для здоровья и безопасности. Важно также знать, где находятся первая помощь и экстренные выходы в случае необходимости.
Вопрос-ответ

Какие металлы реагируют с кислотами?
С кислотами могут реагировать различные металлы. Некоторые из них, такие как натрий, калий и магний, реагируют с кислородной кислотой, например, соляной или азотной, образуя соли и выделяя водород. Однако не все металлы образуют с кислотами химические реакции.
Какие процессы происходят при реакции металлов с кислотами?
При реакции металлов с кислотами происходит образование солей и выделение водорода. Когда металл вступает в контакт с кислотой, происходит окислительно-восстановительная реакция, в результате которой ионы металла переходят в раствор, а ионы водорода выделяются в виде газа.
Для чего используют реакции между кислотами и металлами?
Реакции между кислотами и металлами имеют много различных применений. Например, они используются в процессах очистки металлов от окислов и загрязнений, в производстве водорода, в химическом анализе для определения наличия и концентрации металлов в образцах и многом другом. Эти реакции также изучают в образовательных целях, чтобы понять основы химии и особенности реакций различных веществ.
