Взаимодействие кислот с металлами является одной из важных тем в химии. Это явление имеет применение во многих областях, включая промышленность и науку. Кислоты могут взаимодействовать с металлами различными способами, в зависимости от их свойств и соотношений.
Как правило, такие взаимодействия происходят в результате образования оцидов. Оциды, в свою очередь, представляют собой химические соединения, состоящие из кислорода и металла. Формирование оцидов может сопровождаться различными реакциями, такими как окисление и восстановление металлов.
Одним из факторов, влияющих на реакцию между кислотами и металлами, является их активность. Некоторые металлы, такие как натрий и калий, активно реагируют с кислотами, выделяя водородный газ и образуя соли. Другие металлы могут быть менее активными и образовывать гидроксиды или оксиды при взаимодействии с кислотами.
Взаимодействие кислот с металлами имеет большое практическое значение. Например, оно может использоваться для удаления ржавчины с металлических поверхностей или для получения нужных химических соединений. Понимание основных закономерностей и свойств этого процесса позволяет эффективно использовать его в различных областях науки и промышленности.
Взаимодействие кислот с металлами: основные принципы

Взаимодействие кислот с металлами является одним из фундаментальных процессов в химии. Оно основывается на реакциях окисления-восстановления, в которых металлы передают электроны кислоте. Кислоты могут быть органическими или неорганическими, а металлы могут принадлежать разным группам периодической системы.
Важным фактором, влияющим на взаимодействие кислоты с металлом, является их электрохимический потенциал. Чем больше разница между потенциалами металла и кислоты, тем более интенсивно будет протекать реакция. Например, сильные кислоты, такие как соляная или серная, могут реагировать с большинством металлов и вызывать их коррозию.
При взаимодействии кислоты с металлом происходят следующие процессы: процесс диссоциации кислоты, в котором кислота расщепляется на ионы в растворе; процесс окисления металла, в результате которого металл отдаёт электроны; процесс образования соли, который включает в себя соединение ионов кислоты с ионами металла.
Важно отметить, что в реакциях взаимодействия кислот с металлами образуются соли, которые могут быть растворимыми или нерастворимыми. Соли, образующиеся при реакции, могут иметь различную структуру и свойства, что влияет на их использование в различных сферах науки и промышленности.
Классификация кислот
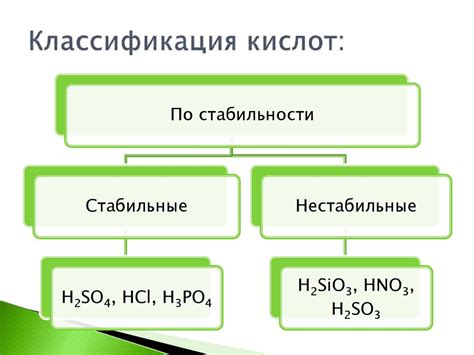
Кислоты классифицируются на основе различных химических свойств и основных составляющих. Существует несколько основных типов кислот, каждый из которых имеет свои особенности и применение.
Минеральные кислоты: эти кислоты образуются в результате растворения некоторых минералов и содержат сильные ионы водорода. К ним относятся, например, серная кислота (H2SO4) и хлороводородная кислота (HCl). Минеральные кислоты широко используются в различных отраслях промышленности и науки.
Органические кислоты: органические кислоты состоят из карбонового каркаса, в который входит один или несколько карбоксильных групп (-COOH). Некоторые известные органические кислоты включают уксусную кислоту (CH3COOH) и лимонную кислоту (C6H8O7). Органические кислоты в основном используются в пищевом производстве, фармацевтике и косметической индустрии.
Сильные и слабые кислоты: кислоты могут быть классифицированы как сильные или слабые в зависимости от их способности отдавать протоны. Сильные кислоты, такие как серная кислота и хлороводородная кислота, полностью диссоциируют в воде и образуют ионы водорода. Слабые кислоты, например уксусная кислота, частично диссоциируют и образуют меньшее количество ионов водорода. Эта классификация важна при изучении реакций кислот с металлами и их взаимодействиями.
Таким образом, классификация кислот позволяет упорядочить разнообразие этих соединений и определить их химические свойства и применение в разных областях жизни и науки.
Реакция кислот с активными металлами
Активные металлы, такие как натрий (Na), калий (K), алюминий (Al) и цинк (Zn), реагируют с кислотами, образуя соли и выделяя водород (H2). Данная реакция является химической и может протекать довольно сильно и быстро.
При взаимодействии активных металлов с кислотами, происходит обмен ионами. Металл замещает в кислоте водород, образуя соль. Например, при взаимодействии натрия с соляной кислотой (HCl), образуется соль натрия (NaCl) и выделяется водород:
- 2Na + 2HCl → 2NaCl + H2
Реакция между активными металлами и кислотами сопровождается выделением пузырьков газа и образованием пены. Выделение водорода может быть легко замечено, так как он обладает горючим свойством и может воспламеняться при контакте с огнем или искрами.
Реакция активных металлов с кислотами может протекать с большим выделением тепла и может быть опасной. При проведении экспериментов или работы с активными металлами и кислотами, необходимо соблюдать меры предосторожности, носить защитные очки и перчатки, а также работать в хорошо проветриваемом помещении.
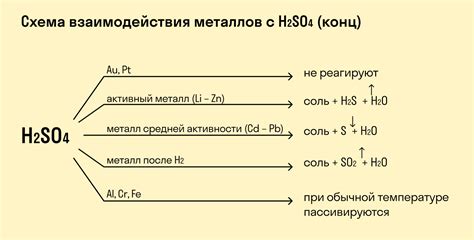
Важно отметить, что не все металлы реагируют с кислотами. Например, серебро (Ag), платина (Pt) и золото (Au) обладают низкой активностью и не реагируют с большинством кислот. Также, некоторые кислоты, такие как серная (H2SO4) или азотная (HNO3), могут реагировать только с определенными металлами, образуя специфические соли.
Окисление металлов при взаимодействии с кислотами
Взаимодействие кислот с различными металлами может приводить к процессу окисления. Окисление - это процесс, при котором металл передает электроны кислороду или другому окислителю. В результате окисления металл превращается в свою соответствующую окись или соли.
Вода является одной из наиболее распространенных кислот, взаимодействие с которой может привести к окислению металлов. Например, чистый металл железо при контакте с воздухом и влагой начинает активно окисляться, образуя обычную ржавчину. Этот процесс называется коррозией.
Окисление металлов при взаимодействии с кислотами может осуществляться в различных условиях. Например, реакция металлов с кислородным водородом, хлороводородом или серной кислотой может быть очень быстрой и интенсивной, образуя соли и выделяя водородный газ.
Важно отметить, что не все металлы одинаково восприимчивы к окислению при взаимодействии с кислотами. Некоторые металлы, такие как платина или золото, имеют высокую устойчивость к окислению и не реагируют с кислотами. Другие металлы, такие как магний или цинк, наоборот, легко окисляются при контакте с кислотами.
Окисление металлов при взаимодействии с кислотами является важным явлением в химии и имеет множество практических применений. Например, окисление алюминия при взаимодействии с кислотами используется в процессе получения алюминиевой фольги, которая является одним из наиболее востребованных материалов в упаковочной и пищевой промышленности.
Влияние концентрации кислоты на реакцию с металлом
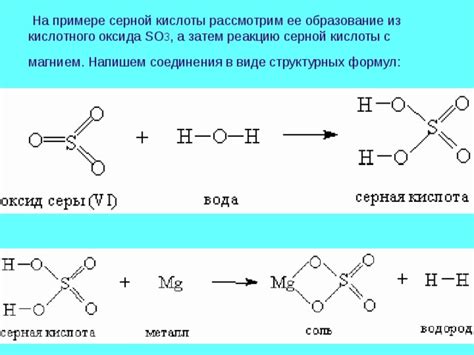
Концентрация кислоты играет важную роль в реакции между кислотами и металлами. Она определяет скорость протекания реакции и ее энергетическую эффективность.
При низкой концентрации кислоты обычно наблюдается медленное растворение металла. Это связано с тем, что количество активных ионов в растворе ограничено и соответственно, скорость их реакции с металлом невелика.
С повышением концентрации кислоты реакция с металлом становится более интенсивной. Это происходит потому, что количество активных ионов увеличивается, что приводит к большему количеству столкновений с металлом и, как следствие, к повышению скорости реакции.
Однако, слишком высокая концентрация кислоты может привести к образованию защитной пленки на поверхности металла, которая затруднит дальнейшее растворение. Это связано с тем, что при высокой концентрации ионов в растворе, они больше времени проводят взаимодействуя между собой, а не с металлом.
Итак, оптимальная концентрация кислоты в реакции с металлом зависит от желаемой скорости реакции и растворимости металла. Это важно учитывать при проведении экспериментов и при выборе соответствующих условий для конкретных задач.
Взаимодействие кислоты с недрагоценными металлами
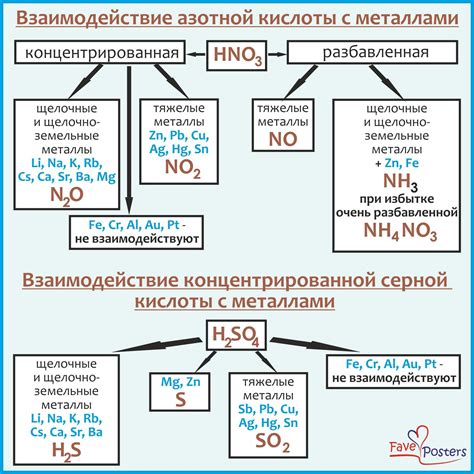
Взаимодействие кислоты с недрагоценными металлами возникает при контакте кислоты с поверхностью металла и может привести к различным химическим реакциям.
Например, соляная кислота (HCl) может реагировать с недрагоценными металлами, такими как железо (Fe), алюминий (Al) и цинк (Zn), образуя соответствующие соли и выделяя водород (H2).
Азотная кислота (HNO3) также может вступать в реакцию с недрагоценными металлами, например, с медью (Cu) и свинцом (Pb), образуя соответствующие нитраты и выделяя водород (H2).
Серная кислота (H2SO4) может реагировать с металлами, такими как железо (Fe), алюминий (Al) и цинк (Zn), образуя соответствующие соли и выделяя сероводород (H2S). Также сульфатная кислота может реагировать с свинцом (Pb) и медью (Cu), образуя соответствующие сульфаты и выделяя сероводород (H2S).
Взаимодействие кислоты с недрагоценными металлами может иметь различные практические применения, например, использоваться для очистки поверхности металла от окислов и загрязнений, а также для получения соединений металлов, используемых в различных отраслях промышленности.
Практическое применение знаний о взаимодействии кислот с металлами

Знание о взаимодействии кислот с металлами имеет широкое практическое применение в различных областях, таких как промышленность, производство и научные исследования. Важно понимать, как кислоты реагируют с различными металлами, чтобы оптимизировать процессы и избежать возможных проблем и повреждений.
Применение знаний о взаимодействии кислот с металлами включает разработку и производство химических реакторов, контейнеров и трубопроводов, устойчивых к агрессивным кислотным средам. Используя подходящие металлы или их сплавы, можно создать материалы, которые выдерживают воздействие кислот и сохраняют свои свойства и структуру.
Также знание о взаимодействии кислот с металлами находит применение в гальванической и электрохимической областях. Для эффективного проектирования и производства элементов и устройств, работающих с кислотами, необходимо учитывать, какие металлы и сплавы могут быть использованы в данной среде и какие материалы подвержены коррозии или образованию отложений.
Знание о взаимодействии кислот с металлами также применяется в процессах очистки и обработки различных материалов. Например, в металлургической промышленности кислоты используются для удаления окисленных слоев с поверхности металла или для получения качественного покрытия на поверхности изделий.
Вопрос-ответ

Что такое кислоты и металлы?
Кислоты - это химические соединения, обладающие кислотными свойствами. Они могут реагировать с различными веществами, в том числе с металлами. Металлы - это элементы, обладающие характерными физическими и химическими свойствами, такими как блеск, проводимость электричества и тепла, и способность реагировать с кислотами.
Как происходит реакция металлов с кислотами?
Реакция металлов с кислотами происходит посредством образования солей и выделения водорода. Металл реагирует с кислотой, образуя соль металла и выделяя водородный газ. Например, реакция железа с соляной кислотой может быть представлена следующим уравнением: Fe + 2HCl -> FeCl2 + H2.
Какие металлы реагируют с кислотами?
Взаимодействие металлов с кислотами зависит от их активности. Наиболее активные металлы, такие как натрий, калий, цезий и литий, реагируют с большинством кислот, включая сильные и слабые. Более реактивные металлы, такие как алюминий и цинк, реагируют только с некоторыми кислотами. Менее активные металлы, такие как железо и медь, не реагируют с некоторыми кислотами, если только они не являются очень сильными.
Какова роль кислот в промышленности?
Кислоты имеют широкое применение в промышленности. Например, серная кислота используется в производстве удобрений, пластмасс, бумаги и многих других химических продуктов. Соляная кислота применяется в производстве солей, хлора и многих других соединений. Фосфорная кислота используется в производстве удобрений и моющих средств. Кислоты также используются в различных электрохимических процессах и в лабораторном анализе.
