Водород – это самый легкий и распространенный элемент в природе, который обладает множеством уникальных химических свойств. Одним из способов получения водорода является его образование при реакции кислот с металлами. Этот процесс основан на переходе электронов от металла к водороду, что приводит к образованию газообразного водорода и соответствующих солей.
Реакция кислот с металлами – это один из классических примеров химических реакций, которые изучают в школе на уроках химии. При взаимодействии кислоты с металлом образуется соль и выделяется газообразный водород.
Ключевыми компонентами этой реакции являются кислота и металл. Кислота дает протоны, которые передаются металлу, приводя к его окислению. При этом водород и соответствующая соль образуются как продукты реакции. Реакция между кислотой и металлом может протекать с разной интенсивностью и скоростью, в зависимости от конкретных условий и реакционных субстанций.
Процесс образования водорода при реакции кислот с металлами имеет большое практическое значение. Водород широко применяется в промышленности и научных исследованиях, а также является перспективным источником энергии в будущем.
Узнать больше о реакции кислот с металлами и его применении можно в дальнейшем чтении данной статьи.
Что такое водород

Водород – химический элемент, наиболее легкий и обычно наименее плотный из всех элементов в природе. Он обладает научной формулой H2 и атомным номером 1. Водород состоит из одного протона и одного электрона.
Водород является наиболее распространенным элементом во Вселенной и встречается в различных формах и соединениях. В природной обстановке водород чаще всего находится в виде газа. Он обладает высокой энергией и используется в различных отраслях промышленности и науки.
Водород имеет множество применений. Он используется в процессе производства аммиака, который является основным компонентом удобрений. Также водород может использоваться в производстве металлов, водородных палочек для сварки и водородных топливных элементах.
Водород является важным и незаменимым элементом в химической промышленности. Он может быть использован в качестве инертного газа для защиты материалов от окисления и при производстве сплавов. Кроме того, водород используется в процессе химических реакций и синтезе веществ.
Водород - легчайший химический элемент

Водород - самый легкий элемент в периодической системе химических элементов. Его атомный номер равен 1, что указывает на его маленькую массу и простоту строения. Водород состоит из одного протона и одного электрона, не имеет нейтронов в ядре. Во вселенной водород является самым распространенным элементом, составляя около 75% ее массы.
Химические свойства водорода обусловлены его простой структурой. Вода и большинство органических соединений содержат водородные связи, которые играют важную роль во многих биологических и химических процессах. Кроме того, водород используется в качестве источника энергии и розничного топлива.
Вода, как известно, состоит из двух атомов водорода и одного атома кислорода. При разломе воды в результате электролиза, образуется водород и кислород в соотношении 2:1. Используя различные методы, можно получить водород и из других веществ, таких как металлы (например, цинк или алюминий), которые реагируют с кислотами, выделяя водород.
В результате реакции кислот с металлами образуется большое количество водорода. Это реакция обращается к любителям интересных химических экспериментов и используется в образовательных целях. Водород играет важную роль в различных научных исследованиях и промышленных процессах, что делает его незаменимым и актуальным элементом для изучения и эксплуатации.
Процесс образования водорода
Образование водорода при реакции кислот с металлами является одним из важных процессов в химии. При соединении кислоты и металла происходит обмен ионами, в результате которого образуется соль и выделяется газ водород.
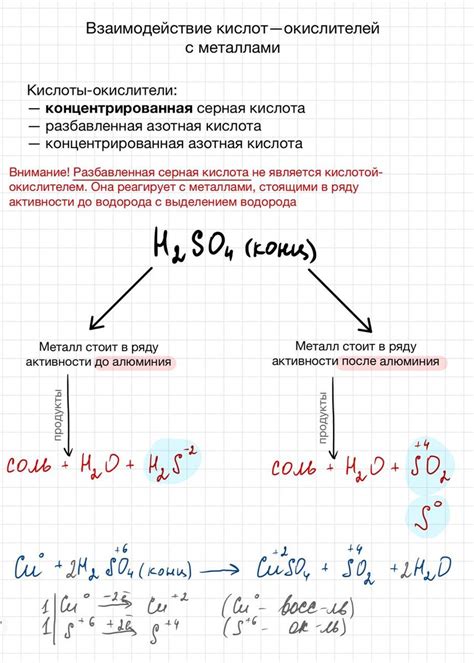
Обычно в качестве кислоты используются сильные одноосновные кислоты, например, соляная кислота (HCl) или серная кислота (H2SO4). В процессе реакции металл разлагает кислоту на ионы водорода и соответствующие соли.
Образование водорода происходит в результате реакции между ионами водорода (H+) и электронами, выделяющимися при окислении металла. Этот процесс называется редокс-реакцией, где металл восстанавливается, а водород окисляется.
Образование водорода при реакции кислот с металлами может быть использовано в различных областях, например, в производстве водородных топливных элементов, как альтернативы источникам энергии на основе нефти и газа. Также этот процесс может быть использован для получения водорода в химических лабораториях.
Реакция кислот с металлами

Реакция кислот с металлами является одной из важных химических реакций. В результате этого процесса происходит образование водорода, а также солей металлов и кислот, в зависимости от реагентов, участвующих в реакции.
Реакция кислот с металлами происходит путем обмена ионами между кислотой и металлом. Кислота отдает протон и превращается в анион, а металл, в свою очередь, отдает электроны и образует положительный ион. При этом образуется соль металла и кислоты, а основным продуктом реакции является образование молекулярного водорода.
Реакция кислот с металлами может быть представлена обобщенным химическим уравнением: 2HCl + Zn → ZnCl2 + H2, где HCl - соляная кислота, Zn - цинк. При этом образуется соль цинка - хлорид цинка, и молекулярный водород выделяется в газообразной форме.
Водород, образующийся в результате реакции кислот с металлами, является важным и перспективным энергетическим носителем, так как его сжигание практически не загрязняет окружающую среду и не выделяет вредных веществ. Поэтому реакция кислот с металлами привлекает внимание ученых и инженеров для возможного использования водорода в качестве альтернативного источника энергии.
- Примеры реакций кислот с металлами:
- 2HCl + 2Al → 2AlCl3 + H2
- 2HNO3 + Cu → Cu(NO3)2 + H2O + NO2
- 2H2SO4 + Fe → FeSO4 + 2H2O + SO2
Реакция кислот с металлами является одной из основных реакций, используемых в химическом образовании. Знание этого процесса позволяет понимать причины и последствия химических реакций, а также применять полученные знания в различных сферах науки и техники.
Взаимодействие кислот с металлами
Взаимодействие кислот с металлами - один из фундаментальных процессов в химии. При этом происходит образование солей и выделение водорода. Кислоты активно реагируют с металлами, так как обладают способностью донорства протонов.
Реакция кислот с металлами происходит по принципу освобождения водорода. Кислоты, такие как соляная кислота, азотная кислота и серная кислота, могут растворять многие металлы, такие как железо, цинк, медь и алюминий.
В ходе реакции, металл выводит протон из кислоты, образуя соответствующую соль и выделяя молекулы водорода. Результатом данной реакции может быть образование солей металлов, которые растворяются в воде.
Взаимодействие кислот с металлами играет большую роль в различных областях, таких как промышленность, энергетика и наука. Например, водород, выделяющийся при реакции кислот с металлами, может быть использован как источник энергии или сырье для производства различных химических соединений.
Кроме того, взаимодействие кислот с металлами является важным объектом изучения в химическом образовании. Это помогает понять основы химических реакций и применение данных реакций в различных практических задачах.
Образование солей и водорода

При взаимодействии кислот с металлами образуются соли и водород. Это связано с химической реакцией между кислотной и металлической частицами.
Реакция кислоты с металлом начинается с образования ионов металла, которые реагируют с ионами водорода из кислоты. Ион металла отдает электроны и превращается в катион, а ион водорода в кислоте принимает электроны и становится нейтральным атомом водорода.
Образованный при реакции водород может быть виден в виде пузырьков, которые поднимаются в растворе. Это происходит из-за того, что водород является легким газом и может легко выйти из раствора в виде пузырьков.
При вмешательстве кислоты с металлом образуются соли - соединения, состоящие из катионов металла и анионов кислоты. Формирование соли происходит из-за сильности связи между частицами кислоты и металла. В результате этой связи образуются стабильные и нерастворимые вещества.
Например, при взаимодействии соляной кислоты и металла натрия образуется хлорид натрия - соль, которая является белым кристаллическим веществом. Таким образом, реакция кислоты с металлом приводит к образованию солей и водорода, что является основой многих химических процессов в природе и промышленности.
Примеры реакций

1. Реакция соляной кислоты с цинком: При взаимодействии соляной кислоты с цинком образуется хлорид цинка и выделяется водород. Уравнение реакции выглядит следующим образом:
2 HCl + Zn -> ZnCl2 + H2
2. Реакция соляной кислоты с алюминием: В результате реакции соляной кислоты с алюминием образуется хлорид алюминия и выделяется водород. Уравнение реакции имеет следующий вид:
6 HCl + 2 Al -> 2 AlCl3 + 3 H2
3. Реакция соляной кислоты с железом: При взаимодействии соляной кислоты с железом образуется хлорид железа и выделяется водород. Реакция может быть представлена следующим уравнением:
6 HCl + 2 Fe -> 2 FeCl3 + 3 H2
4. Реакция соляной кислоты с магнием: Реакция соляной кислоты с магнием приводит к образованию хлорида магния и выделению водорода. Уравнение реакции записывается следующим образом:
2 HCl + Mg -> MgCl2 + H2
5. Реакция соляной кислоты с натрием: В ходе взаимодействия соляной кислоты с натрием образуется хлорид натрия и выделяется водород. Уравнение реакции принимает следующий вид:
2 HCl + 2 Na -> 2 NaCl + H2
Реакция соляной кислоты с цинком
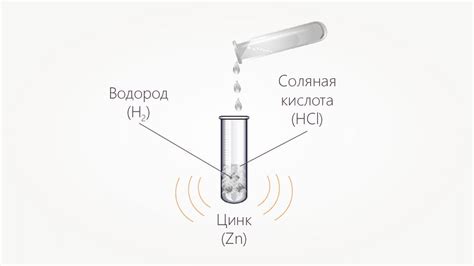
Реакция соляной кислоты с цинком является классическим примером реакции, в результате которой образуется водород. Соляная кислота (HCl) обладает сильными кислотными свойствами, а цинк (Zn) является активным металлом. При соединении этих веществ происходит реакция, в результате которой образуется хлорид цинка (ZnCl2) и молекулярный водород (H2).
Реакция соляной кислоты с цинком можно описать следующим уравнением:
Zn + 2HCl → ZnCl2 + H2
Реакция протекает с выделением газа водорода. Газ образуется в виде пузырьков и может быть обнаружен путем прикладывания к реакционной смеси зажженной спички: в результате возникает характерное "щелчковое" звуковое сопровождение и появление пламени.
Реакция соляной кислоты с цинком хорошо иллюстрирует принципы реакции металла с кислотой и образования водорода. Данная реакция также может использоваться в образовательных целях для демонстрации основных химических принципов и свойств веществ.
Применение водорода
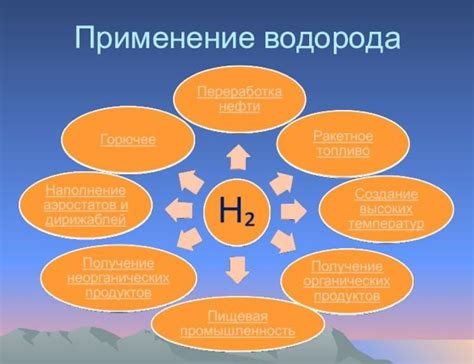
Водород, получаемый при реакции кислот с металлами, является исключительно важным веществом, которое находит широкое применение в различных сферах деятельности человека.
Одним из главных применений водорода является его использование в процессе производства энергии. Водород может быть использован в качестве альтернативного источника энергии, не загрязняющего окружающую среду. С помощью специальных устройств, называемых водородными топливными элементами, водород можно преобразовать в электрическую энергию, которую можно использовать для питания автомобилей, генерации электричества и других энергетических процессов.
Водород также широко применяется в химическом производстве. Он используется в процессах синтеза и превращения различных химических соединений, таких как аммиак, метанол, спирт и другие органические вещества. Благодаря своей высокой реакционной способности, водород является важным компонентом многих промышленных процессов, позволяющих получать различные химические продукты и материалы.
Кроме того, водород находит применение в области анализа и исследовании материалов. Его возможность реагировать с различными веществами позволяет использовать водород в качестве индикатора при проведении химических экспериментов. Водород также может быть использован для создания вакуума в лабораториях для проведения определенных экспериментов и измерений. Более того, водород является важным ингредиентом в процессах плавки и отжига металлов, что делает его неотъемлемым элементом в металлургической и горнодобывающей промышленности.
Водород как источник энергии
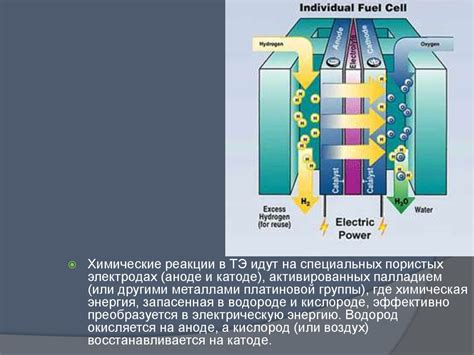
Водород - это самый обильный элемент во Вселенной, и он является потенциально безграничным источником энергии. В отличие от традиционных источников энергии, таких как нефть и уголь, водород может быть добыт из воды и других возобновляемых источников.
Одним из самых эффективных способов получения водорода является его выделение при реакции кислот с металлами, такими как цинк или алюминий. В результате такой реакции образуется водород и соответствующая соль металла.
Водород может быть использован в различных областях и секторах экономики. Он может служить как источник энергии для производства электричества и тепла, так и для питания транспортных средств. Водородные топливные элементы, работающие на основе водорода, уже используются для питания автомобилей, автобусов и даже железнодорожного транспорта.
Одним из главных преимуществ водорода как источника энергии является его экологическая чистота. При сгорании водорода образуется только вода, что делает его отличной альтернативой традиционным источникам энергии, которые являются одним из основных источников выбросов парниковых газов и загрязнения окружающей среды.
Водород также имеет высокую энергетическую плотность, что означает, что большое количество энергии может быть хранено в маленьком объеме. Это делает его привлекательным для использования в различных сферах, включая мобильные и портативные устройства.
Однако, несмотря на все преимущества, использование водорода как источника энергии все еще сопряжено с некоторыми техническими и экономическими сложностями. Для широкого распространения водородных технологий необходимы дальнейшие исследования и инновации в области производства, хранения и использования водорода.
Вопрос-ответ

Какие кислоты можно использовать для реакции с металлами?
Для реакции с металлами можно использовать различные кислоты, такие как соляная кислота (HCl), серная кислота (H2SO4), азотная кислота (HNO3) и другие.
Как происходит образование водорода при реакции кислот с металлами?
При реакции кислоты с металлом происходит образование соли и выделение водорода. Кислота действует как окислитель, а металл - как восстановитель. В результате происходит обмен электронами и образуется водородный газ.
Какие металлы реагируют с кислотами?
С кислотами могут реагировать различные металлы, включая активные металлы, такие как натрий (Na), калий (K), магний (Mg), алюминий (Al), и более реактивные металлы, такие как цинк (Zn), железо (Fe), медь (Cu) и другие.
