Металл цинк – весьма активное вещество, которое активно реагирует с различными кислотами в химических реакциях. Одной из основных особенностей взаимодействия цинка с кислотами является его способность вытеснять из раствора молекулы водорода, что приводит к выделению газа и образованию соответствующих солей.
Одним из наиболее распространенных примеров взаимодействия цинка с кислотами является его реакция с соляной кислотой. В ходе этой реакции знакомство с индексами реактивов поможет понять, почему через равное количество времени исходные реактивы могут оставаться в растворах, что позволяет ситуативно оценить соль, речь идет об окислении вещества.
Так, при взаимодействии цинка с соляной кислотой, происходит образование соли цинка хлорида и выделение молекул водорода. Реакция может быть представлена следующим уравнением: Zn + 2HCl = ZnCl2 + H2.При этом, заметим интересный факт: цинка негипоскопическое вещество, т.е. поглощает воду только в газообразном состоянии и влажном показывает свои активные свойства также за счет реакций с кислотами.
Взаимодействие цинка с другими кислотами имеет свои особенности. Так, с азотной кислотой он образует соль цинк нитрата и выделяет оксид азота, в реакции с серной кислотой получается сульфат цинка и выделяется диоксид серы. Кроме того, взаимодействие цинка с фосфорной кислотой может привести к образованию фосфата цинка и выделению молекулы газообразного фосфора.
Взаимодействие металла цинка с кислотами: способы и реакции

Цинк является активным металлом, который может вступать во взаимодействие с различными кислотами, образуя соли и выделяя водород. Это взаимодействие является реакцией окисления-восстановления, при которой цинк окисляется, а кислород соединения восстанавливается.
Одним из способов взаимодействия цинка с кислотами является растворение металла в кислоте. Например, при взаимодействии цинка с серной кислотой образуется сульфат цинка (ZnSO4) и выделяется водород:
Zn + H2SO4 → ZnSO4 + H2↑
Другим способом взаимодействия цинка с кислотами является замена водорода в кислоте на металл. Например, при реакции цинка с соляной кислотой образуется хлорид цинка (ZnCl2) и выделяется водород:
Zn + 2HCl → ZnCl2 + H2↑
Взаимодействие цинка с кислотами также может протекать при наличии воды. В этом случае образуется сера и выделяется водород:
Zn + 2H2O → Zn(OH)2 + H2↑
Таким образом, взаимодействие металла цинка с кислотами происходит по разным механизмам и приводит к образованию различных солей и выделению водорода. Эти реакции активно используются в химических и промышленных процессах.
Механизм взаимодействия металла цинка с кислотами

Металл цинк является активным элементом, который способен реагировать с различными кислотами.
Когда цинк вступает в контакт с кислотой, начинается реакция, в результате которой происходит образование соли цинка и выделение водорода.
Процесс взаимодействия металла цинка с кислотами основан на высокой активности цинка и его способности отдавать электроны. Когда цинк вступает в реакцию с кислотой, он отдаёт электроны кислоте, что приводит к образованию ионов цинка и ионов гидрогена. Ионы цинка образуют соль цинка, а ионы гидрогена соединяются для образования молекул водорода.
Например, при растворении цинка в соляной кислоте происходит следующая реакция:
- Цинк реагирует с соляной кислотой, отдавая два электрона.
- Из кислоты образуется ион хлорида, а цинк переходит в ионную форму Zn2+.
- Образовавшиеся ионы вступают во взаимодействие с водородными ионами из кислоты, образуя молекулы водорода H2.
- В итоге получается соль цинка и молекулы водорода, которые могут образовывать пузырьки газа.
Важно отметить, что скорость реакции между цинком и кислотой зависит от различных факторов, таких как концентрация кислоты, температура и поверхность цинка. При повышении концентрации кислоты или повышении температуры скорость реакции увеличивается.
Реакция цинка с соляной кислотой: особенности и химическое уравнение
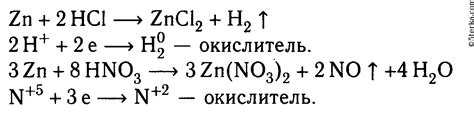
Реакция металла цинка с соляной кислотой является классическим примером взаимодействия металлов с кислотами. В ходе этой реакции образуется соль цинка и водород.
Основной особенностью этой реакции является способность цинка активно реагировать с соляной кислотой, выделяя при этом водородный газ. Цинк действует в качестве окислителя, окисляясь до иона цинка Zn^2+. В свою очередь, соляная кислота действует в качестве восстановителя, восстанавливая цинк из ионного состояния благодаря передаче электронов.
Химическое уравнение реакции цинка с соляной кислотой можно записать следующим образом:
Zn + 2HCl → ZnCl2 + H2
Где Zn обозначает металл цинк, HCl - соляную кислоту, ZnCl2 - хлорид цинка, H2 - молекулы водорода.
Таким образом, реакция металла цинка с соляной кислотой позволяет наблюдать химическое взаимодействие между металлом и кислотой и образование новых веществ.
Влияние концентрации кислоты на реакцию с цинком

Реакция металла цинка с кислотами является одной из наиболее изученных в химии. Ее особенностью является зависимость скорости и интенсивности реакции от концентрации кислоты, с которой происходит взаимодействие.
Чем выше концентрация кислоты, тем быстрее происходит реакция металла цинка с ней. Это связано с тем, что концентрация кислоты влияет на число частиц, с которыми металл вступает в контакт. Чем больше частиц кислоты, тем больше возможностей для соударения с поверхностью цинка, что способствует более интенсивной реакции.
Однако, необходимо отметить, что высокая концентрация кислоты может также вызвать необратимые изменения в структуре цинка, что может привести к его разрушению или потере свойств. Поэтому важно соблюдать оптимальные условия взаимодействия с цинком, чтобы не нарушить его структуру и свойства.
Также стоит отметить, что влияние концентрации кислоты на реакцию с цинком можно исследовать путем проведения серии экспериментов с различными концентрациями кислоты и измерения скорости реакции. Это позволит получить более точную информацию о зависимости между концентрацией кислоты и интенсивностью реакции металла цинка.
В целом, концентрация кислоты играет важную роль в реакции металла цинка с кислотами, влияя на скорость и интенсивность реакции. Правильное подбор концентрации кислоты позволяет достичь желаемого результата взаимодействия с цинком, минимизируя возможные негативные последствия для металла.
Применение взаимодействия цинка с кислотами в промышленности и быту

Взаимодействие металла цинка с кислотами находит широкое применение в промышленности и быту благодаря своим уникальным свойствам. Цинк считается химически активным металлом, который обладает способностью растворяться в разных кислотах, особенно в сильных.
Одним из основных применений взаимодействия цинка с кислотами является использование этого процесса для получения водорода. При взаимодействии цинка с соляной кислотой образуется водород, который можно использовать для различных технических и бытовых нужд. Этот метод является эффективным и экологически безопасным и применяется в различных областях промышленности и энергетики.
Взаимодействие цинка с кислотами также находит применение в производстве батарей. Цинк используется в качестве электрода в гальванических элементах и алкалиновых батареях. При реакции цинка с кислотой в батарее происходит выделение энергии, которая используется для подачи электричества. Это позволяет создавать портативные и долговечные источники энергии для различных устройств и электроники.
Взаимодействие цинка с кислотами также имеет применение в пищевой промышленности. Цинк используется в качестве добавки в некоторые пищевые продукты, так как он является важным микроэлементом для организма человека. Он участвует в метаболических процессах, иммунной системе и регулировании гормонального баланса. Добавление цинка в пищевые продукты позволяет обогатить их полезными свойствами и способствует поддержанию здоровья.
Взаимодействие цинка с кислотами также имеет применение в производстве металлических покрытий. Цинк применяется в качестве защитного покрытия для различных металлических поверхностей, таких как железо и сталь. Это позволяет предотвратить коррозию и повреждения металла от воздействия окружающей среды. Металлические покрытия с цинком имеют высокую стойкость к агрессивным факторам и широко используются в строительстве, автомобильной и электротехнической промышленности.
Вопрос-ответ

Что происходит при взаимодействии металла цинка с кислотами?
При взаимодействии металла цинка с кислотами происходит химическая реакция, в результате которой образуется соль и выделяется водород.
Почему металл цинк реагирует с кислотами?
Металл цинк реагирует с кислотами, так как он обладает активностью, способностью вступать в химические реакции. При этой реакции происходит окисление цинка и восстановление водорода.
Какие кислоты реагируют с металлом цинком?
Металл цинк реагирует с различными кислотами, например с соляной кислотой (HCl), серной кислотой (H2SO4), азотной кислотой (HNO3) и другими. Однако реакция может протекать с различной скоростью и сопровождаться различными явлениями в зависимости от конкретной кислоты.
Чем особенна реакция цинка с соляной кислотой?
При реакции цинка с соляной кислотой образуется хлорид цинка и выделяется водород. Особенностью этой реакции является выделение газа с пузырьками, а также характерный запах водорода.
Как можно использовать реакцию цинка с кислотой в повседневной жизни?
Реакцию цинка с кислотой можно использовать для различных практических целей. Например, при необходимости получить водород, можно добавить металлический цинк в кислоту и собирать выделяющийся газ. Также цинк используется для гальванического покрытия изделий, чтобы защитить их от коррозии.
