Оксиды являются одной из самых распространенных классов неорганических соединений. Они образуются при взаимодействии кислорода с металлами и являются основными конституентами минералов и рудных полезных ископаемых.
Реакция кислорода с металлами происходит с выделением тепла и может быть сопровождена интенсивным горением. При этом образуются различные оксиды, которые обладают разными свойствами и могут использоваться в различных отраслях промышленности.
Каждый металл имеет свой характер реакции с кислородом. Некоторые металлы, такие как магний или алюминий, образуют оксиды сильно щелочного характера. Другие металлы, такие как железо или медь, образуют оксиды сильно кислотного характера. Оксиды металлов могут быть как ионными, так и молекулярными соединениями, в зависимости от их химического строения.
Образование оксидов является фундаментальным процессом в химии и основой для понимания многих реакций и свойств неорганических соединений. Изучение реакции кислорода с металлами позволяет понять, какие условия могут привести к образованию определенных типов оксидов и какие свойства они будут иметь.
Образование оксидов в реакции кислорода с металлами
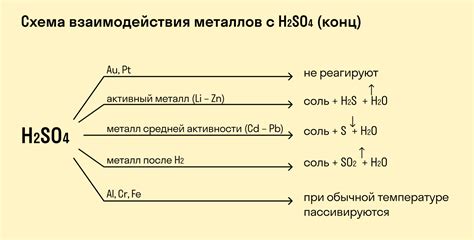
Оксиды являются одним из наиболее широко распространенных классов химических соединений. Они образуются в результате реакции кислорода с различными веществами, включая металлы. Реакция кислорода с металлами является одной из основных реакций в химии и играет важную роль в различных процессах, включая ржавление металлов и окисление веществ.
При реакции кислорода с металлами образуются соединения, называемые оксидами. Оксиды металлов являются ионными соединениями, состоящими из металлических и кислородных ионов. Образующиеся оксиды могут иметь различные степени окисления металла, что определяет их свойства и характер взаимодействия с другими веществами.
Образование оксидов при реакции кислорода с металлами может происходить при различных условиях. Например, некоторые металлы могут гореть на воздухе, образуя оксиды. Это происходит в результате реакции металла с кислородом воздуха. Другими способами образования оксидов являются нагревание металлов в присутствии кислорода или их растворение в кислородсодержащих растворителях.
Оксиды, образующиеся в результате реакции кислорода с металлами, обладают различными свойствами и имеют широкий спектр применений. Некоторые оксиды металлов используются в качестве катализаторов, сырья для производства других соединений или материалов, а также в различных отраслях промышленности, включая металлургию, электронику, строительство и другие.
Важность реакции кислорода с металлами

Реакция кислорода с металлами является одной из основных химических реакций, которые влияют на множество аспектов нашей жизни. Эта реакция играет важную роль в различных отраслях, таких как производство металлургических материалов, электроника, строительство и окружающая среда.
Одним из наиболее значимых аспектов реакции кислорода с металлами является создание оксидов. Оксиды металлов широко используются в производстве различных материалов, в том числе стекла, керамики и металлических сплавов. Они также являются неотъемлемой частью процесса окрашивания и гальванизации различных поверхностей.
Более того, реакция кислорода с металлами играет важную роль в производстве электроэнергии. Например, в гальванических элементах происходит реакция кислорода с металлами, что позволяет генерировать электрический ток. Также, водородные топливные элементы используют эту реакцию для генерации электроэнергии. Реакция кислорода с металлами также играет важную роль в процессах сохранения пищевых продуктов и при очистке воды.
Кроме того, реакция кислорода с металлами влияет на окружающую среду. Например, реакция окисления железа приводит к образованию ржавчины, которая может повредить сооружения и инфраструктуру. А реакция кислорода с металлическими загрязнителями, такими как свинец и ртуть, может привести к образованию токсичных оксидов, которые негативно влияют на здоровье человека и экосистему.
Чем обусловено образование оксида при реакции металла с кислородом
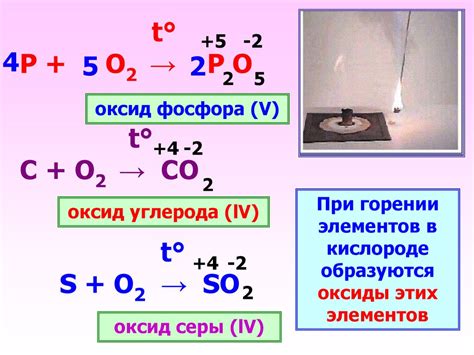
Образование оксида при реакции металла с кислородом обусловлено химическим взаимодействием этих двух веществ. Реакция металла с кислородом может протекать с разной интенсивностью в зависимости от свойств металла и условий окружающей среды.
В реакции с кислородом, металл окисляется, теряя электроны, а кислород восстанавливается, получая электроны. Это взаимодействие приводит к образованию молекулы оксида металла, которая имеет специфические химические свойства.
Образование оксида между металлом и кислородом происходит в результате реакции, которая может быть самопроизвольной или стимулированной внешними факторами, такими как температура и давление. Более активные металлы, такие как натрий или калий, соединяются с кислородом значительно быстрее и более интенсивно, чем менее реакционные металлы, такие как серебро или золото.
Реакция образования оксида металла с кислородом может иметь различные последствия в зависимости от химических свойств образовавшегося соединения. Оксиды могут быть кислотными, щелочными или нейтральными в зависимости от характера соединения и его способности образовать ионизированные частицы. Эти свойства могут быть использованы в различных промышленных процессах и технологиях, а также в химических реакциях и экспериментах в научных исследованиях.
Основные типы оксидов, образующихся в результате реакции кислорода с металлами
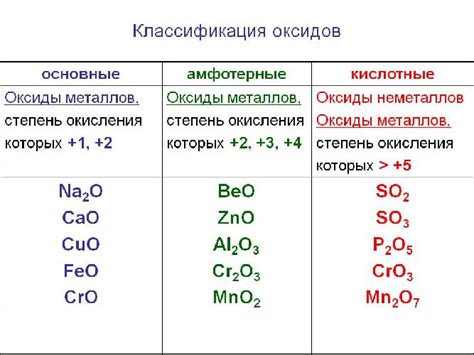
Реакция кислорода с металлами может приводить к образованию различных типов оксидов. Оксиды - это химические соединения, состоящие из кислорода и другого элемента, в данном случае - металла. В зависимости от свойств металла и условий реакции, образуются разные типы оксидов.
Одним из основных типов оксидов являются неокислы. Они образуются в результате реакции кислорода с щелочными металлами, такими как натрий, калий и литий. Неокислы характеризуются наличием положительного заряда у металла и отрицательного заряда у кислорода.
Еще одним типом оксидов являются псевдоокислы. Они образуются при реакции кислорода с амфотерными металлами, такими как алюминий, цинк, свинец. Псевдоокислы отличаются тем, что металл в них может иметь как положительный, так и отрицательный заряд.
Также можно выделить переходные оксиды, которые образуются при реакции кислорода с переходными металлами, такими как железо, медь, цинк. Переходные оксиды обладают разнообразными свойствами, их химическая формула может быть разной в зависимости от состояния металла.
Кроме того, существуют и другие типы оксидов, такие как основные оксиды, который образуются в результате реакции кислорода с металлическими основаниями, и кислотные оксиды, которые образуются при реакции кислорода с металлическими кислотами. Каждый тип оксидов имеет свои уникальные свойства и применение.
Химические свойства оксидов, получаемых в результате реакции кислорода с металлами

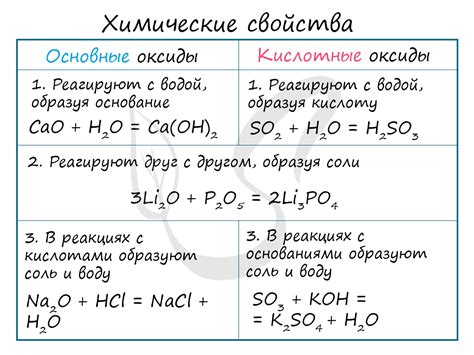
Оксиды - это химические соединения, образующиеся в результате реакции металлов с кислородом. В процессе протекания этой реакции образуются различные типы оксидов, включая базовые, амфотерные и кислотные оксиды.
Базовные оксиды образуются при реакции активных металлов с кислородом. Эти оксиды обладают щелочными свойствами и растворяются в воде, образуя щелочные растворы или гидроксиды. Например, оксид натрия (Na2O) при растворении в воде образует гидроксид натрия (NaOH), который широко используется в промышленности и быту.
Амфотерные оксиды обладают свойствами как оснований, так и кислот. Это означает, что амфотерные оксиды могут реагировать как с кислотами, так и с щелочами. Примером амфотерного оксида является оксид алюминия (Al2O3), который может реагировать и с сильными кислотами, и с сильными основаниями.
Кислотные оксиды образуются при реакции неметаллов и металлов с кислородом. Эти оксиды обладают кислотными свойствами и растворяются в воде, образуя кислотные растворы. Например, оксид серы (SO2) может растворяться в воде, образуя сульфитную кислоту (H2SO3), которая является слабой кислотой.
Оксиды играют важную роль в химии и применяются в различных областях, включая производство стекла, керамики, металлургию и электронику. Изучение свойств оксидов, получаемых в результате реакции кислорода с металлами, позволяет лучше понять химические процессы, происходящие вокруг нас.
Важность оксидов, получаемых из реакции кислорода с металлами в различных отраслях промышленности
Оксиды, получаемые из реакции кислорода с металлами, имеют огромное значение в различных отраслях промышленности. Эти соединения играют ключевую роль в производстве многих материалов и продуктов, используемых повсеместно.
Строительная промышленность: Оксиды металлов, такие как алюминиевый оксид и железооксид, широко используются в производстве строительных материалов. Они добавляются в цемент, что улучшает его физические свойства и защищает конструкции от повреждений. Кроме того, оксиды металлов могут использоваться как наполнители для производства строительных композитных материалов.
Металлургия: В металлургической промышленности оксиды играют важную роль при производстве металлов. Например, оксид железа (FeO) используется для получения чистого железа при обработке железной руды. Оксидалюминия (Al2O3) применяется для изготовления алюминия.
Электроника: Оксиды металлов находят широкое применение в электронной промышленности. Так, оксид кремния (SiO2) используется в производстве полупроводниковых чипов, а оксид титана (TiO2) применяется в создании пленок для солнечных батарей.
Химическая промышленность: Оксиды металлов являются прекурсорами для получения различных химических веществ. Оксид алюминия (Al2O3) используется в производстве катализаторов, а оксид кобальта (CoO) – в производстве магнитных материалов.
Лекарственная промышленность: Многие оксиды металлов используются в медицине для создания лекарств и добавок к пище. Например, оксид цинка (ZnO) является одним из ключевых ингредиентов в солнцезащитных кремах.
Таким образом, оксиды, получаемые из реакции кислорода с металлами, играют важную роль в различных отраслях промышленности, обеспечивая производство необходимых материалов и продуктов, которые используются в повседневной жизни.
Влияние условий реакции на образование оксидов при взаимодействии кислорода с металлами
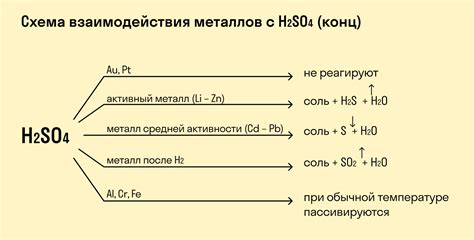
Взаимодействие кислорода с металлами является одним из важных процессов, приводящих к образованию оксидов. Как правило, при этой реакции кислород вступает в соединение с металлом, образуя оксид металла. Условия реакции имеют значительное влияние на образование и свойства полученных оксидов.
Одним из параметров, который оказывает влияние на образование оксидов, является концентрация кислорода. При повышении концентрации кислорода происходит более интенсивное окисление металла и образование более высокоокисленного оксида. Например, медь при взаимодействии с кислородом образует оксид меди (II) CuO, однако при более высокой концентрации кислорода может быть образован оксид меди (I) Cu2O.
Температура реакции также оказывает влияние на образование оксидов. При повышении температуры реакция протекает более интенсивно, что может привести к образованию более высокоокисленных оксидов. Например, железо при нагревании на воздухе окисляется, образуя ржавчину (оксид железа III) Fe2O3, тогда как при низких температурах образуется оксид железа II FeO.
Также влиять на образование оксидов могут физические условия, такие как давление и влажность. Под воздействием высокого давления и наличия влаги при взаимодействии кислорода с металлами может происходить образование гидроксидов, а не оксидов. Например, алюминий при длительном контакте с влажным кислородом окисляется, образуя гидроксид алюминия Al(OH)3 вместо оксида алюминия Al2O3.
Практическое применение оксидов, образующихся при реакции кислорода с металлами
Оксиды, образующиеся при реакции кислорода с металлами, находят широкое практическое применение в различных отраслях производства и технологии. Они являются важными компонентами в производстве разнообразных материалов и веществ.
Одним из практических применений оксидов является их использование в архитектуре и строительстве. Например, оксид алюминия (алюминиевая глина) используется в качестве связующего компонента для производства кирпичей, керамической плитки и других строительных материалов. В результате реакции кислорода с алюминием образуется оксид алюминия, который обладает высокой прочностью и стойкостью к воздействию внешних факторов.
Другим примером практического применения оксидов является их использование в производстве стекла. Например, оксид серебра особенно полезен при создании зеркал и стекол с зеркальным покрытием. Оксид серебра (Ag2O) обладает высокой прозрачностью и способностью отражать свет, что делает его идеальным материалом для зеркальных поверхностей.
Оксиды также широко применяются в электротехнике и электронике. Например, оксид свинца (PbO) используется в производстве электролитических конденсаторов и аккумуляторов. Оксиды также играют важную роль в процессах каталитического окисления для удаления вредных веществ и очистки отходов.
Таким образом, оксиды, образующиеся при реакции кислорода с металлами, имеют множество практических применений в различных областях производства и технологии. Их уникальные свойства делают их незаменимыми в создании разнообразных материалов и веществ, которые используются в нашей повседневной жизни.
Вопрос-ответ

Какие металлы способны реагировать с кислородом?
Реакция кислорода с металлами возможна только у некоторых металлов. К ним относятся щелочные металлы (например, литий, натрий, калий), щелочноземельные металлы (например, магний, кальций, барий) и алюминий.
Что происходит при реакции кислорода с металлами?
При реакции кислорода с металлами образуются оксиды металлов. Во время реакции металлы окисляются, а кислород восстанавливается. Образование оксидов – это одна из основных реакций металлов с кислородом.
Зачем металлу реагировать с кислородом?
Реакция металлов с кислородом очень важна, так как позволяет получать ценные продукты. Например, реакция кислорода с металлами используется для получения металлических оксидов, которые широко применяются в промышленности, в процессе производства стекла и керамики, а также для получения металлов по высокотемпературным методам.
