Включение HNO3 в химические реакции с металлами имеет широкое применение в различных областях науки и промышленности. Нитратная кислота, также известная как азотная кислота, является одним из наиболее активных окислителей и используется во многих химических процессах. Ее взаимодействие с металлами может приводить к различным химическим реакциям и образованию особых соединений.
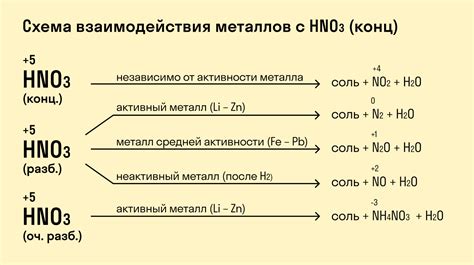
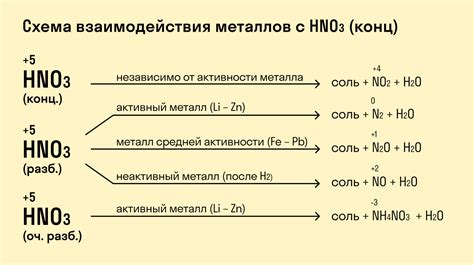
В зависимости от концентрации и условий реакции, HNO3 может окислять металлы до различных степеней окисления. При взаимодействии с активными металлами, такими как натрий или калий, нитратная кислота может вызывать интенсивное взаимодействие, сопровождающееся выпуском газообразных продуктов и выделением тепла. В этом случае образуются нитратные соли металлов и освобождается диоксид азота (NO2).
Однако не все металлы могут эффективно реагировать с нитратной кислотой. Некоторые металлы, такие как алюминий или свинец, могут образовывать пассивную пленку оксида на поверхности, которая предохраняет их от дальнейшего окисления и реакции с HNO3. В этом случае взаимодействие протекает очень медленно или вообще не происходит.
Взаимодействие HNO3 с металлами имеет значительное применение в производстве различных химических соединений, в том числе в процессе получения нитратов и азотной кислоты. Также оно является object-поджанром взаимодействия кислоты с металлами, что делает его важным объектом исследований в области химии и материаловедения.
Химические реакции HNO3 с металлами
Кислота азотной (HNO3) является одной из наиболее распространенных и активных кислот в химии. Ее взаимодействие с металлами приводит к различным химическим реакциям, которые зависят от свойств и химической активности металла. В результате этих реакций может происходить растворение металла, образование оксидов или солей.
Взаимодействие HNO3 с активными металлами, такими как натрий (Na), калий (K) или магний (Mg), приводит к интенсивному газообразованию в виде окислов азота (NO и NO2). Это обусловлено высокой активностью этих металлов, которые образуют стабильные нитраты в результате реакции.
Оксиды азота, образующиеся в результате взаимодействия HNO3 с металлами, являются сильными окислителями и обладают яркой красновато-коричневой окраской. Они довольно токсичны и могут образовывать взрывоопасные смеси с другими веществами.
Некоторые металлы, такие как железо (Fe) или цинк (Zn), реагируют с HNO3, образуя нитраты. Растворение металла происходит постепенно и может сопровождаться выделением газа в виде оксида азота. Образованные нитраты растворяются в воде и образуют прозрачный раствор.
Также возможна реакция HNO3 с алюминием (Al), которая приводит к образованию пассивной оксидной пленки на поверхности металла. Эта пленка служит защитой для алюминия от дальнейшего воздействия кислоты и препятствует ее растворению.
В зависимости от концентрации и условий реакции, взаимодействие HNO3 с металлами может протекать с различной интенсивностью и образованием характерных продуктов. Эти реакции имеют практическое значение при производстве химических соединений, а также в аналитической химии для определения содержания металлов в различных образцах.
Взаимодействие HNO3 с щелочными металлами
Щелочные металлы, такие как натрий (Na), калий (K) и литий (Li), являются одними из наиболее активных элементов в периодической системе. Взаимодействие этих металлов с агрессивными окислителями, такими как азотная кислота (HNO3), может привести к различным химическим реакциям.
При смешивании HNO3 с щелочными металлами происходит реакция окисления, в результате которой образуются нитраты щелочных металлов. Например, при взаимодействии натрия с азотной кислотой образуется нитрат натрия (NaNO3).
Уравнение реакции между HNO3 и натрием может быть записано следующим образом:
2Na + 2HNO3 → 2NaNO3 + H2
Кроме того, при взаимодействии HNO3 с щелочными металлами может происходить выделение газа. Например, при взаимодействии калия с азотной кислотой образуется нитрат калия (KNO3) и выделяется газовый продукт – оксид азота (NO). Уравнение реакции в данном случае будет выглядеть так:
2K + 2HNO3 → 2KNO3 + H2O + 2NO
Взаимодействие HNO3 с щелочными металлами является горячей и интенсивной химической реакцией, в результате которой образуются нитраты металлов и могут выделяться газовые продукты. Данные реакции являются важными в химической промышленности и научных исследованиях.
Реакции HNO3 с щелочно-земельными металлами
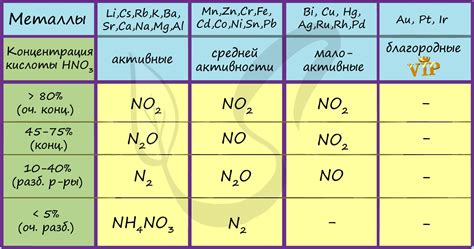
Кислота азотной серной (HNO3) обладает сильным окислительным свойством и активно взаимодействует с металлами. Щелочно-земельные металлы, такие как магний (Mg), кальций (Ca), стронций (Sr) и барий (Ba), также подвержены реакции с HNO3.
Реакция металлов с HNO3 происходит с образованием соответствующих нитратов и освобождением газа двуокиси азота (N2O). Это газ является красновато-коричневой жидкостью, имеющей неприятный запах.
Пример реакции:
| Металл | Уравнение реакции |
|---|---|
| Mg | 3Mg + 8HNO3 → 3Mg(NO3)2 + 2NO + 4H2O |
| Ca | 2Ca + 8HNO3 → 2Ca(NO3)2 + 2NO + 4H2O |
| Sr | 2Sr + 10HNO3 → 2Sr(NO3)2 + 2NO + 5H2O |
| Ba | Ba + 10HNO3 → Ba(NO3)2 + 2NO + 5H2O |
Реакция HNO3 с щелочно-земельными металлами является быстрой и интенсивной, при этом выделяется большое количество тепла. Образовавшиеся нитраты растворяются в воде, образуя нитратные ионы.
Важно отметить, что при растворении нитратов щелочно-земельных металлов в воде происходит образование щелочных растворов, что объясняет название этих металлов. Эти растворы обладают щелочными свойствами и используются в многих процессах промышленности и сельском хозяйстве.
Итак, реакции HNO3 с щелочно-земельными металлами происходят с образованием нитратных солей и выделением газа двуокиси азота. Они протекают быстро и с выделением тепла. Образовавшиеся нитраты растворяются в воде, образуя щелочные растворы, которые находят широкое применение в различных отраслях промышленности и сельском хозяйстве.
Взаимодействие HNO3 с переходными металлами
Переходные металлы представляют собой группу химических элементов, которые обладают способностью образования различных ионов с разной степенью окисления. Взаимодействие переходных металлов с HNO3 также имеет свои особенности.
Когда переходные металлы вступают в реакцию с HNO3, происходит образование соответствующих нитратов. Например, реакция железа (Fe) с HNO3 приводит к образованию нитрата железа (III), Fe(NO3)3. Полученный нитрат является солевой формой азотной кислоты, в которой железо обладает степенью окисления +3.
Каждый переходный металл вступает в реакцию с HNO3 с разной интенсивностью в зависимости от своего состояния окисления и электрохимической активности. Некоторые металлы, например, медь (Cu), образуют нитраты непосредственно, при этом выделяется оксид азота и вода. Другие металлы, такие как цинк (Zn) и алюминий (Al), имеют более высокую активность и поэтому реагируют более интенсивно, выделяя газы (аммиак и оксиды азота) и образуя специфические нитраты.
Важно отметить, что HNO3 может также действовать на поверхность переходных металлов, вызывая коррозию и образование пассивной пленки. Это может негативно повлиять на химическую стабильность и электрохимические свойства переходных металлов, что необходимо учитывать при использовании HNO3 в процессах обработки и очистки переходных металлов.
Химические реакции HNO3 с благородными металлами
Химическое взаимодействие азотной кислоты (HNO3) с благородными металлами, такими как золото, платина и серебро, происходит с образованием различных соединений и может протекать с разной интенсивностью в зависимости от условий реакции.
Одной из основных характеристик реакции HNO3 с благородными металлами является их стойкость к окислению. Это обусловлено высокой активностью благородных металлов и наличием стабильной пленки окисления на их поверхности, которая предотвращает дальнейшее окисление.
Однако, при взаимодействии HNO3 с благородными металлами, также могут происходить некоторые реакции. Так, с серебром HNO3 образует соединение AgNO3, которое является хорошим окислителем и используется в аналитической химии.
В случае взаимодействия HNO3 с золотом, происходит образование соединений AuNO3 и Au(NO3)3. В зависимости от концентрации и условий реакции, может происходить растворение золота или образование осадка. Это свойство HNO3 использовалось в процессе растворения и извлечения золота из руд.
При реакции HNO3 с платиной, образуется соединение Pt(NO3)2. Однако, платина обладает высокой стойкостью к окислению и реакция с HNO3 происходит медленно и не столь интенсивно, как с другими благородными металлами.
Взаимодействие HNO3 с благородными металлами является важным аспектом в химических исследованиях и промышленных процессах, где эти металлы применяются. Изучение и контроль данных реакций позволяет эффективно использовать благородные металлы и их соединения в различных областях применения.
Особенности взаимодействия HNO3 с металлами
1. Окисляющие свойства: HNO3 является сильным окислителем и может взаимодействовать с металлами, приводя к их окислению. При этом, сам HNO3 восстанавливается до молекулярного азота (N2) и воды (H2O).
2. Образование солей: В результате взаимодействия HNO3 с металлами образуются нитраты. Нитраты могут быть растворимыми или нерастворимыми в воде в зависимости от специфических свойств каждого металла и условий реакции.
3. Реакция с выделением газа: Некоторые металлы (например, железо, цинк) при взаимодействии с HNO3 в основном формируют нитраты и выделяются диоксид азота (NO2) в газообразном состоянии. Это происходит из-за отрицательного окислительного потенциала HNO3 по отношению к NO2.
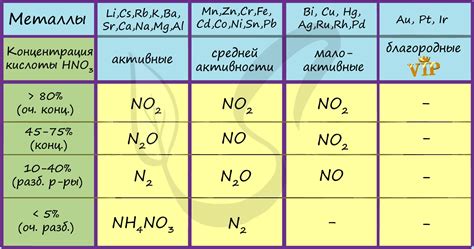
4. Влияние концентрации: Скорость реакции между HNO3 и металлами зависит от концентрации кислоты. При повышенной концентрации реакция может идти более интенсивно, приводя к быстрому окислению металла.
5. Защитная пленка: У некоторых металлов (например, алюминий и нержавеющая сталь) формируется тонкая пленка оксида, которая защищает металл от дальнейшего окисления HNO3. Это является причиной того, что эти металлы могут быть устойчивы к воздействию HNO3 при комнатной температуре.
6. Выбор металла: Выбор металла для взаимодействия с HNO3 зависит от условий реакции и требуемого результата. Некоторые металлы могут быть полностью окислены HNO3, другие могут образовывать растворимые или нерастворимые соли, а некоторые металлы могут быть устойчивы к воздействию кислоты.
В целом, взаимодействие HNO3 с металлами является важным химическим процессом, который может быть использован в различных промышленных и научных целях. Понимание особенностей этого взаимодействия позволяет более эффективно использовать HNO3 и металлы для достижения нужных результатов.
Вопрос-ответ

Что произойдет при взаимодействии HNO3 с металлами?
При взаимодействии HNO3 с металлами образуется соответствующий нитрат, водород и нитрит.
Какие особенности есть во взаимодействии HNO3 с металлами?
Особенности взаимодействия HNO3 с металлами включают образование нитрата металла, образование водорода и нитрита, а также возможность разложения HNO3 с образованием оксида азота.
