Взаимодействие серной кислоты (H2SO4) с металлами является одной из важнейших реакций в химии. Серная кислота, являющаяся одним из наиболее распространенных химических соединений, обладает сильными окислительными свойствами и активно реагирует с многими металлами, образуя соответствующие соли и выделяя водород. Особенно интересным объектом для исследования является концентрированная реакция H2SO4 с металлами, которая происходит при высокой концентрации и высокой температуре.
При взаимодействии концентрированной серной кислоты с металлами происходит интенсивное окисление металлов. Металлы обесцвечиваются и растворяются в серной кислоте, образуя соответствующие соли, водород и иногда оксид серы. В результате возникают разнообразные химические реакции, которые могут сопровождаться выделением тепла, пенистым наполнением раствора и образованием сильно концентрированной кислотной пары.
Концентрированная реакция H2SO4 с металлами широко используется в различных областях промышленности и научных исследований. Она является не только объектом химического анализа, но и основой для получения различных соединений и материалов, а также для проведения экспериментов с целью изучения химических процессов. Разбор этой реакции позволяет лучше понять особенности взаимодействия H2SO4 с металлами и использовать их в различных практических целях.
Химические свойства H2SO4
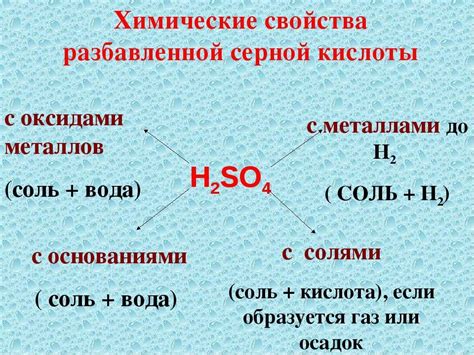
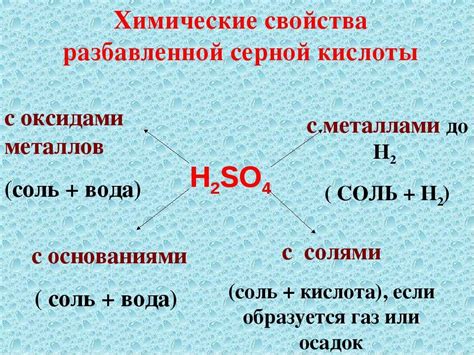
Сульфатная кислота (H2SO4) – это одна из самых сильных кислот, которая широко применяется в химической и промышленной областях. Её химические свойства делают её одной из наиболее реакционных и опасных веществ.
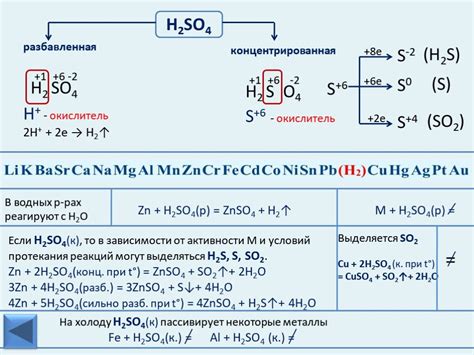
Реакция с металлами: H2SO4 может реагировать с различными металлами, образуя соли и выделяя водород. При этом скорость реакции зависит от типа металла. Алюминий, цинк и железо взаимодействуют с H2SO4, образуя соответственно сульфат алюминия (Al2(SO4)3), сульфат цинка (ZnSO4) и сульфат железа (FeSO4). Также реакция H2SO4 с активными металлами, такими как натрий или калий, может протекать с разрушительным эффектом, выделяя большое количество водорода и тепла.
Действие на органику: H2SO4 является агрессивным действующим химическим веществом и может вызывать серьезные химические ожоги на коже и слизистых оболочках при прямом контакте. Кроме того, H2SO4 используется в реакциях дегидрации и сульфатации органических соединений, таких как спирты или алкалоиды. В результате таких реакций происходит образование новых соединений с изменением их физических и химических свойств.
Реакция с щелочами: Взаимодействие H2SO4 с щелочами, такими как гидроксид натрия (NaOH) или гидроксид калия (KOH), приводит к образованию соли (сульфата) и воды. Например, реакцией между H2SO4 и NaOH получается сульфат натрия (Na2SO4) и вода.
Роль H2SO4 в взаимодействии с металлами

Кислота серной (H2SO4) играет важную роль в химической реакции с металлами. Эта реакция является классическим примером окислительно-восстановительного процесса, где H2SO4 действует в качестве окислителя.
Во время взаимодействия H2SO4 с металлами происходит электронный перенос соединений между молекулами кислоты и металла. H2SO4 служит источником водорода (H2), который образуется при взаимодействии кислоты с активными металлами, такими как цинк (Zn) или железо (Fe).
Однако, металлы более высокого порядка, такие как медь (Cu) или серебро (Ag), не подвергаются окислительному воздействию кислоты серной концентрированной, поскольку они обладают малой химической активностью. H2SO4 не способна окислять эти металлы до образования ионов.
В процессе взаимодействия с металлами, H2SO4 проявляет свои кислотные свойства в растворе. Она отжимает ион водорода (H+) от воды, формируя тем самым более высокую активность кислоты. Этот процесс называется диссоциацией кислоты серной и играет важную роль в ее реакции с металлами.
В целом, реакция H2SO4 с металлами демонстрирует основные принципы окислительно-восстановительной химии. Изучение этого процесса важно для понимания взаимодействия различных веществ и их роли в химических реакциях.
Особенности концентрированной реакции с металлами
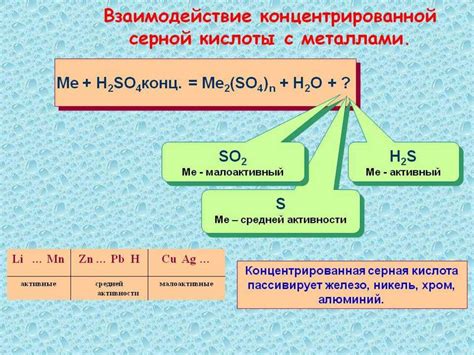
Концентрированная реакция H2SO4 с металлами обладает рядом особенностей, которые необходимо учитывать при проведении данных химических превращений.
Во-первых, концентрированная серная кислота является сильным окислителем и реагирует с большой активностью с металлами, особенно с активными металлами, такими как натрий, калий, магний и алюминий. При этом происходит окислительно-восстановительная реакция: металл окисляется, а серная кислота восстанавливается.
Во-вторых, концентрированное действие серной кислоты вызывает интенсивное выделение газов, в основном водорода. При взаимодействии металла с H2SO4 образуется сульфат металла и обильное выделение газа.
В-третьих, температура концентрированной реакции с металлами велика, что может привести к интенсивному испарению кислоты и ее хлорированию, особенно при длительном воздействии света.
Таким образом, концентрированная реакция с металлами требует аккуратного и осторожного обращения, поскольку она является химически активным и опасным процессом.
Реакции неметаллических элементов с H2SO4
Концентрированная серная кислота (H2SO4) имеет сильное окислительное действие и может реагировать с различными неметаллическими элементами, образуя разнообразные соединения. Реакция неметаллических элементов с H2SO4 может быть экзотермической и происходить с выделением тепла.
Одним из примеров такой реакции является взаимодействие серной кислоты с углеродом. При этом образуется углекислый газ (CO2) и вода. Углерод выпадает в виде чёрного осадка. Углеродные страны, используемые в газоанализаторах, широко применяются для определения концентрации ионов веществ и топливной станции.
Некоторые неметаллические элементы, такие как фосфор и сероводород, могут проявлять амфотерное поведение, то есть образовывать и окислительные, и восстановительные соединения с H2SO4. Реакция фосфора с серной кислотой может происходить с выделением фосфорной кислоты и сернистого газа. Сероводород может взаимодействовать с H2SO4, образуя серу и воду.
Реакции неметаллических элементов с H2SO4 могут быть сложными и протекать в несколько этапов. Например, реакция серы с серной кислотой происходит в несколько стадий и образует различные оксиды серы. Эти оксиды могут в дальнейшем реагировать с водой, образуя сульфаты и соединения серы с кислородом.
В целом, реакции неметаллических элементов с H2SO4 имеют важное значение во многих областях, таких как химическая промышленность, анализ веществ и экология. Изучение этих реакций помогает понять свойства неметаллических элементов и их поведение в химических системах.
Практическое применение реакции H2SO4 с металлами
Реакция серной кислоты (H2SO4) с металлами имеет широкое практическое применение в различных областях науки и промышленности.
В химической промышленности серная кислота используется для производства сульфатов, которые находят применение в производстве удобрений, жидкостей для охлаждения двигателей и других смазочных материалов, а также в текстильной и пищевой промышленности.
Реакция H2SO4 с металлами также используется для получения водорода. Водород является важным энергетическим носителем и используется в процессе синтеза аммиака, воды для питья, а также в промышленных процессах, таких как производство металлов и рафинирование нефти.
Кроме того, реакция серной кислоты с металлами может использоваться в лабораториях для получения соответствующих сульфатов и изучения свойств различных веществ.
Таким образом, реакция H2SO4 с металлами находит широкое применение в различных сферах деятельности, начиная от промышленности и заканчивая научными исследованиями.
Опасности и меры предосторожности при работе с концентрированным H2SO4
Концентрированная серная кислота (H2SO4) является сильным окислителем и крайне опасным веществом для человека.
Значительные опасности при работе с H2SO4 связаны с ее высокой реактивностью и агрессивными свойствами. При контакте с кожей или слизистыми оболочками серная кислота может вызывать ожоги и поражение тканей.
Меры предосторожности при работе с концентрированным H2SO4 включают:
- Ношение защитной экипировки. При работе с H2SO4 необходимо использовать кислотоупорную лабораторную одежду, резиновые перчатки, защитные очки или маску, а также кислотостойкую обувь.
- Работа в хорошо проветриваемом помещении. Испарения концентрированной серной кислоты ядовиты и могут вызвать раздражение дыхательных путей. Поэтому необходимо работать в хорошо вентилируемых помещениях или под вытяжным шкафом.
- Осторожная обработка и хранение. Необходимо избегать проливания и резких изменений температуры при работе с H2SO4. Кислота должна храниться в хорошо закрытых и помеченных контейнерах, вдали от органических веществ, легковоспламеняющихся материалов и источников огня.
- Тщательное соблюдение инструкций. При работе с концентрированным H2SO4 необходимо соблюдать инструкции и руководства по безопасности. Особое внимание следует уделять правилам распределения, смешения кислот и реагентов, а также адекватной нейтрализации отходов.
Важно помнить, что работа с концентрированной серной кислотой требует возможно высокого уровня безопасности и глубокого понимания свойств и характеристик этого вещества. Неправильное обращение с H2SO4 может привести к серьезным травмам, так что необходимо быть всегда бдительным и осторожным при работе с этим веществом.
Выводы по взаимодействию H2SO4 с металлами
1. Общие закономерности реакции
Взаимодействие серной кислоты (H2SO4) с металлами является химической реакцией, при которой происходит образование солей серной кислоты, водорода и воды. Реакция может протекать при разных условиях, в зависимости от концентрации серной кислоты и химических свойств металла.
2. Влияние концентрации серной кислоты
При взаимодействии металлов с различными концентрациями H2SO4 наблюдаются различные результаты. При низкой концентрации кислоты реакция может протекать медленно или быть неявной. При высокой концентрации кислоты протекание реакции может быть более интенсивным, с образованием большего количества водорода.
3. Реакционная способность металлов
Реакция H2SO4 с металлами зависит от их химической активности. В качестве общего правила, более активные металлы (например, алюминий, цинк) быстро реагируют с серной кислотой, образуя соли и выделяя водород. Менее активные металлы, такие как медь или серебро, могут не реагировать с концентрированной серной кислотой без нагревания.
4. Образование солей
В результате реакции H2SO4 с металлами образуются соли серной кислоты, которые могут быть различного цвета и характера. Например, реакция с металлом железа приводит к образованию соли серы Железа(II)сульфат, а реакция с металлом меди приводит к образованию соли меди(II)сульфат. Соли могут использоваться в различных отраслях промышленности и научных исследованиях.
5. Практическое применение
Знание о взаимодействии H2SO4 с металлами имеет практическое применение в различных областях. Например, реактивы на основе серной кислоты могут использоваться для очистки поверхностей от старых красок или окисленных слоев. В промышленности серную кислоту часто используют для нанесения защитных покрытий на металлические поверхности, а также в химическом анализе и производстве лекарственных препаратов.
Вопрос-ответ

Что происходит при взаимодействии H2SO4 с металлами?
При взаимодействии H2SO4 с металлами происходит реакция окисления металла со снижением H2SO4. Результатом реакции является образование соли металла и выделение водорода.
Каков механизм взаимодействия H2SO4 с металлами?
Механизм взаимодействия H2SO4 с металлами состоит из нескольких стадий. Сначала протон воды отщепляется от молекулы H2SO4, образуя H3O+. Далее ионы H3O+ образуются HSO4- в результате отщепления водорода, который переходит на поверхность металла. На поверхности металла ионы HSO4- взаимодействуют с металлом, окисляя его и образуя соли металла.
