Углекислый газ (H2CO3) является важным средством взаимодействия с металлами, приводящими к образованию различных соединений и проведению реакций. Взаимодействие металлов с H2CO3 может приводить к образованию углекислых солей, которые имеют широкий спектр применения, а также высокую важность в различных отраслях науки и техники.
При взаимодействии металлов с H2CO3 образуются различные углекислые соли, например, карбонаты и гидрокарбонаты. Карбонаты образуются в результате реакции сильных металлов, таких как натрий, калий и кальций, которые образуют устойчивые соединения в виде нерастворимых карбонатов металлов.
Однако, в случае, если металл является более слабым, такие как железо или цинк, взаимодействие с H2CO3 может приводить к образованию гидрокарбонатов, которые являются растворимыми соединениями. Такие реакции широко применяются в промышленности и реализуются при помощи специальных установок и реакторов, предназначенных для производства гидрокарбонатов.
Взаимодействие металлов с H2CO3

Вода является хорошим растворителем для многих веществ, включая углекислый газ (H2CO3). H2CO3 реагирует с металлами, образуя соединения и вызывая различные химические реакции.
Взаимодействие металлов с H2CO3 зависит от их активности. Некоторые металлы, такие как цинк (Zn) и железо (Fe), реагируют с H2CO3, образуя ионные соединения. Например, реакция между цинком и H2CO3 приводит к образованию иона цинка (Zn2+) и иона карбоната (CO32-):
Zn + H2CO3 -> ZnCO3 + H2
Другие металлы, такие как алюминий (Al) и кальций (Ca), реагируют с H2CO3, образуя гидроксиды и выделяя углекислый газ. Например, реакция между алюминием и H2CO3 приводит к образованию гидроксида алюминия (Al(OH)3) и выделению углекислого газа:
2Al + 3H2CO3 -> Al(OH)3 + 3CO2
Некоторые металлы, такие как медь (Cu) и серебро (Ag), не реагируют с H2CO3. Они являются химически инертными и не образуют соединений с углекислым газом.
Взаимодействие металлов с H2CO3 имеет важное значение в промышленности и научных исследованиях. Например, ионные соединения, образуемые при реакции между металлами и H2CO3, могут использоваться в процессах очистки воды или производства лекарственных препаратов. Также, изучение реакций между металлами и H2CO3 позволяет лучше понять химические свойства металлов и разработать новые материалы с определенными свойствами.
Реакции металлов с H2CO3
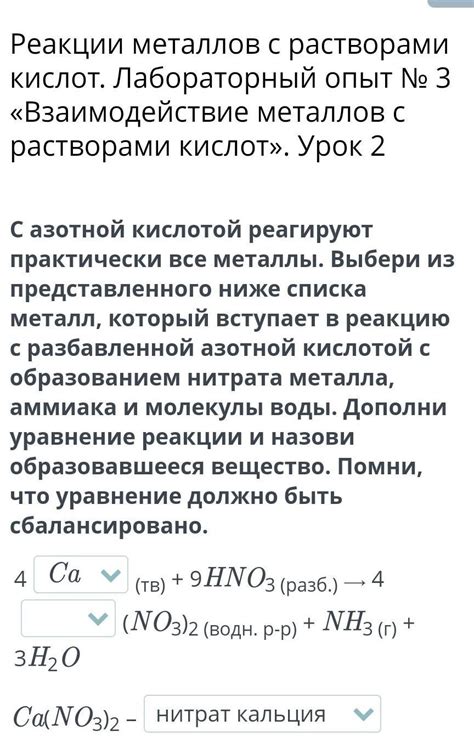
Металлы могут реагировать с H2CO3, представленной в виде угольной кислоты, и образовывать соединения. Такие реакции имеют большое значение как в химической промышленности, так и в ежедневной жизни.
Распространенным примером реакции металла с H2CO3 является образование углекислого натрия (Na2CO3) при взаимодействии натрия (Na) с угольной кислотой. Эта реакция можно представить следующим уравнением:
2Na + H2CO3 → Na2CO3 + H2
Другой пример – реакция цинка (Zn) с угольной кислотой, приводящая к образованию углекислого цинка (ZnCO3) и выделению водорода (H2). Уравнение реакции выглядит следующим образом:
Zn + H2CO3 → ZnCO3 + H2
Не все металлы образуют соединения с H2CO3. Некоторые металлы, такие как золото (Au) и серебро (Ag), не реагируют с угольной кислотой. Однако большинство активных металлов, таких как алюминий (Al), железо (Fe) и магний (Mg), способны реагировать с H2CO3, образуя соответствующие соединения и выделяя газ.
Реакции металлов с H2CO3 также могут быть использованы в качестве метода их анализа. Например, с помощью реакции алюминия с угольной кислотой можно определить наличие алюминия в неизвестном образце.
Таким образом, реакции металлов с H2CO3 представляют важный аспект в химии и имеют широкое применение в различных областях, от промышленности до научных исследований.
Образование соединений металлов с H2CO3

Угольная кислота (H2CO3) может реагировать с различными металлами, образуя соединения. Это происходит из-за активности металлов и их способности вступать в химические реакции с кислотами.
Самая распространенная реакция образования соединений металлов с H2CO3 – реакция с карбонатами. Например, хлорид меди (CuCl2) реагирует с угольной кислотой, образуя карбонат меди (CuCO3).
Соединения, образованные в результате реакции металлов с H2CO3, могут обладать различными свойствами. Некоторые из них могут быть проводниками электричества, что делает их полезными в промышленности и производстве электронных устройств. Кроме того, некоторые соединения могут использоваться в качестве катализаторов, а другие – в производстве красителей и пигментов.
Следует отметить, что не все металлы реагируют с H2CO3 одинаково. Некоторые металлы, такие как железо (Fe) и цинк (Zn), реагируют с угольной кислотой только при повышенных температурах или в присутствии специальных катализаторов.
Образование соединений металлов с H2CO3 является важным процессом в химии и имеет значительное практическое применение. Изучение этих реакций позволяет лучше понять свойства металлов и использовать их в различных областях человеческой деятельности.
Влияние pH на взаимодействие H2CO3 с металлами
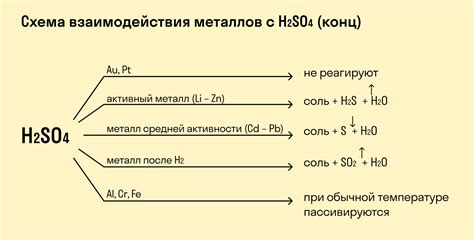
Уровень pH играет важную роль в химических реакциях между H2CO3 и металлами. H2CO3, или угольная кислота, является слабой кислотой, которая может реагировать с многими металлами, образуя соединения и вызывая химические реакции. Однако, итоговый результат этого взаимодействия зависит от значения pH среды, в которой происходит реакция.
При нейтральном pH (около 7) H2CO3 образует карбонатные соединения с многими металлами, такие как кальций, магний и алюминий. Карбонатные соединения обычно слабо растворимы в воде и могут образовать осадок или накипь на поверхности металла. Таким образом, нейтральное pH может привести к коррозии металлических поверхностей.
При низком pH (кислотной среде) H2CO3 проявляет себя как более активная кислота. Она может растворять металлы, такие как железо и алюминий, образуя ионные растворы металлов. Это может привести к коррозии и разрушению металлических поверхностей.
При высоком pH (щелочной среде) H2CO3 переходит в бикарбонатные и карбонатные ионы, которые слабы по отношению к металлам. Все-таки, некоторые металлы, такие как алюминий и некоторые сплавы, все равно могут реагировать с H2CO3 и образовывать соединения, но скорость реакции будет ниже и результаты будут менее разрушительными.
Из вышесказанного следует, что pH среды является ключевым фактором, влияющим на взаимодействие H2CO3 с металлами. Поддержание сбалансированного pH окружающей среды, а также предотвращение накопления H2CO3 на металлических поверхностях могут быть важными мерами для предотвращения коррозии и повреждения металлов.
Влияние pH на скорость реакции H2CO3 с металлом

Реакция H2CO3 с металлами является химической реакцией, которая может иметь различную скорость в зависимости от pH раствора. pH раствора определяет его кислотность или щелочность, что влияет на химические свойства реагентов и их взаимодействие.
При нейтральных значениях pH (около 7) реакция между H2CO3 и металлами, такими как железо, алюминий или цинк, может происходить медленно или вообще не происходить. Нейтральная среда не способствует распаду H2CO3 на ионы водорода и карбоната, что затрудняет его взаимодействие с металлами.
Однако, при изменении pH раствора H2CO3 путем добавления кислоты или щелочи, скорость реакции может значительно возрасти. Например, при низком pH (кислой среде) взаимодействие H2CO3 с металлами может протекать более интенсивно, так как в кислой среде кислота H2CO3 распадается на ионы водорода и карбоната, что способствует более активному контакту с металлом.
С другой стороны, при высоком pH (щелочная среда) металлы могут быть защищены от реакции с H2CO3. Это связано с тем, что в щелочных условиях кислота H2CO3 не распадается на ионы водорода и карбоната, ослабляя свое взаимодействие с металлами.
Таким образом, pH раствора играет важную роль в скорости реакции H2CO3 с металлами. Нейтральная среда замедляет или подавляет реакцию, в то время как кислая или щелочная среда может способствовать ее ускорению или замедлению в зависимости от конкретных условий взаимодействия.
pH-зависимость образования соединений металлов с H2CO3

Одним из важнейших факторов, влияющих на образование соединений металлов с H2CO3, является pH среды. Наиболее благоприятный pH для образования данных соединений обычно составляет от 3 до 5. Ниже этого диапазона происходит интенсивное разложение угольной кислоты и формирование карбонатов металлов в значительно меньших количествах. Выше указанного pH реакция становится затруднительной из-за выделения углекислого газа.
На структуру и свойства образующихся соединений также влияет природа металла. Например, образование карбоната легкометаллов (например, натрия или калия) происходит легче и при более высоких pH, чем у тяжелых металлов (например, свинца или меди), требующих более кислого pH.
Кроме того, pH-зависимость образования соединений металлов с H2CO3 определяет степень их растворимости. Например, при нейтральном pH карбонаты кальция и магния практически не растворяются, в то время как карбонаты легкометаллов хорошо растворяются. Растворимость карбонатов металлов также зависит от других факторов, таких как ионная сила раствора и наличие других химических веществ в системе.
Важно отметить, что pH-зависимость образования соединений металлов с H2CO3 может влиять на коррозионные процессы. Например, при низком pH карбонаты металлов образуются в меньших количествах, что может привести к повышенной коррозии металлов.
В целом, понимание pH-зависимости образования соединений металлов с H2CO3 является важным аспектом изучения их химических свойств и применений в различных областях, включая промышленность, медицину и экологию.
Вопрос-ответ

Какова роль H2CO3 в реакциях с металлами?
H2CO3 играет роль слабой кислоты и способна реагировать с металлами, образуя соли и выделяя газ.
Какие соединения могут образовываться при реакции металлов с H2CO3?
При реакции металлов с H2CO3 могут образовываться соединения в виде солей H2CO3, например, NaHCO3 или KHCO3, а также выделяться углекислый газ CO2.
Каков химический состав H2CO3?
H2CO3 представляет собой двухзамещенную карбоновую кислоту, состоящую из двух атомов водорода, одного атома углерода и трех атомов кислорода.
Может ли H2CO3 вступать в реакцию с любыми металлами?
H2CO3 обычно реагирует только с активными металлами, такими как натрий, калий или алюминий. Неактивные металлы, такие как железо или медь, обычно не реагируют с H2CO3.
