Одной из важных областей химии является изучение реакций между галогенами и оксидами металлов. Галогены - это элементы группы 17 периодической системы, а оксиды металлов представляют собой химические соединения, содержащие кислород связанный с металлом.
Взаимодействие галогенов с оксидами металлов может привести к образованию различных продуктов. В зависимости от условий и типа веществ, реакция может быть эндотермической или экзотермической. Галогены могут быть как окислителями, так и восстановителями при этой реакции.
В результате реакции галогенов с оксидами металлов может образоваться галогенид металла или кислородсодержащий продукт. Например, хлор может вытеснить кислород из оксида меди, образуя хлорид меди, а кислород выделяется в виде газа. Эта реакция может происходить при нагревании в присутствии катализатора или под воздействием света.
Химические свойства галогенов

Галогены - это группа химических элементов, включающая фтор (F), хлор (Cl), бром (Br) и йод (I). У них сходная химическая структура и свойства, которые определяют их высокую реакционность.
Галогены активно взаимодействуют с многими веществами, включая оксиды металлов. Они могут выступать в роли окислителей, принимая электроны от металла. Это приводит к образованию солей галогенидов металлов и освобождению свободного галогена.
Галогены образуют двойные связи с металлами, образуя прочные ковалентные связи. Эта особенность позволяет галогенам образовывать стойкие соединения с металлами и использоваться в различных промышленных процессах.
Галогены также проявляют антисептические свойства и широко применяются в медицине и стерилизации. Например, хлор используется для обеззараживания питьевой воды, а йод - в препаратах для лечения ран и инфекций.
- Фтор - самый реакционный галоген, обладает высокой электроотрицательностью и способностью образовывать стойкие и химически инертные соединения.
- Хлор - широко используется в производстве химических препаратов, пестицидов, пластиков и многих других продуктов. Также является необходимым элементом для живых организмов.
- Бром - активно применяется в фотографии, производстве огнезащитных материалов и веществ для очистки бассейнов и водоемов.
- Йод - широко распространенный микроэлемент, необходимый для нормального функционирования щитовидной железы у человека. Также используется в медицине для дезинфекции и лечения ран и заболеваний.
Химические свойства оксидов металлов
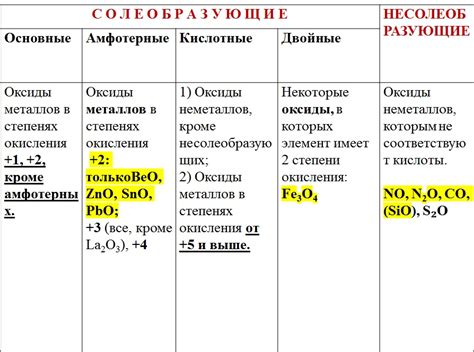
Оксиды металлов – это неорганические соединения, состоящие из кислорода и одного или нескольких металлов. У них могут быть различные свойства и поведение в химических реакциях.
1. Кислотные свойства. Некоторые оксиды металлов проявляют кислотные свойства и способны реагировать с основаниями, образуя соли. Например, оксид меди (II) реагирует с гидроксидом натрия, образуя соль купрум(II) гидроксид: CuO + 2NaOH = Cu(OH)2 + Na2O.
2. Щелочные свойства. Другие оксиды металлов могут обладать щелочными свойствами и реагировать с кислотами, образуя соли и воду. Например, оксид кальция реагирует с соляной кислотой, образуя хлорид кальция и воду: CaO + 2HCl = CaCl2 + H2O.
3. Амфотерные свойства. Некоторые оксиды металлов проявляют амфотерные свойства и могут реагировать как с кислотами, так и с основаниями. Например, оксид алюминия реагирует с соляной кислотой и гидроксидом натрия, образуя соответственно алюминий хлорид и алюминий гидроксид: Al2O3 + 6HCl = 2AlCl3 + 3H2O; Al2O3 + 2NaOH = 2NaAlO2 + H2O.
4. Реакция с галогенами. Оксиды металлов могут реагировать с галогенами, образуя оксигалогенаты. Например, оксид железа (III) реагирует с хлором, образуя трихлорид железа (III) и оксид хлора: Fe2O3 + 6Cl2 = 2FeCl3 + 3Cl2O.
Химические свойства оксидов металлов зависят от их состава, структуры и электрохимических свойств. Эти свойства определяют возможные взаимодействия оксидов металлов с другими веществами и позволяют использовать их в различных промышленных и научных областях.
Взаимодействие галогенов с оксидами металлов

Галогены (хлор, бром, йод) представляют собой активные элементы, способные образовывать соединения с различными веществами. В свою очередь, оксиды металлов являются соединениями металла с кислородом. Взаимодействие галогенов с оксидами металлов происходит при высоких температурах и сопровождается химическими реакциями.
Одной из основных реакций взаимодействия галогенов с оксидами металлов является образование галогенидов металлов и кислорода. Например, при нагревании хлора с оксидом меди (II) образуется хлорид меди (I) и выделяется кислород:
- 2CuO + Cl₂ → 2CuCl + O₂
При этом хлор участвует в окислительно-восстановительных реакциях, переходя из хлорида меди (II) в хлорид меди (I). Таким образом, взаимодействие галогена с оксидом металла представляет собой сложную реакцию, при которой происходит изменение оксидационного состояния галогена и оксида металла.
Взаимодействие галогенов с оксидами металлов имеет широкое применение в различных отраслях химической промышленности. Например, процесс образования хлорида меди (I) может быть использован для получения этого соединения в лабораторных условиях. Также взаимодействие галогенов с оксидами металлов является одним из методов получения галогенидов металлов, которые используются как катализаторы в химической промышленности.
Особенности реакции хлора с оксидами металлов
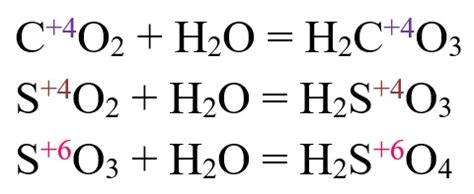
Реакция хлора с оксидами металлов проявляет ряд особенностей, связанных с химическими свойствами данных веществ.
Во-первых, реакция хлора с оксидами металлов часто происходит при высоких температурах, что связано с необходимостью активации процесса окисления-восстановления и разрушения связей в молекулах соединений.
Во-вторых, реакция может протекать как с образованием хлоридов металлов, так и с образованием хлоратов, в зависимости от условий реакции и свойств металла.
Также, реакция хлора с оксидами металлов может проявляться в виде окисления металла и одновременном выделении хлороводорода, что является результатом разрушения соединений и образования новых веществ.
В целом, реакция хлора с оксидами металлов представляет собой сложный процесс, требующий определенных условий и производства, и может приводить к образованию различных химических соединений в зависимости от свойств металла и оксида.
Особенности реакции брома с оксидами металлов
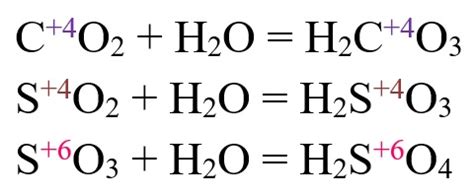
Бром – элемент химической группы галогенов, обладает высокой реакционной способностью. Его реакция с оксидами металлов имеет свои особенности и может проявляться в различных возможных взаимодействиях.
Один из основных вариантов реакции брома с оксидами металлов – образование галогенсодержащих кислот. При соединении брома с металлическим оксидом образуется хлорид металла и хлорсодержащая кислота. Такие реакции протекают с выделением тепла и могут использоваться, например, для получения кислорода из оксида меди.
Еще одним возможным вариантом реакции является образование оксогалогенидов металлов. Оксогалогениды представляют собой соли галогенсодержащих кислот, в которых галоген замещает кислородный атом. В случае реакции брома с оксидами металлов получаются бромиды металлов и соответствующие оксогалогениды.
Реакция брома с оксидами металлов может протекать и в других направлениях, в зависимости от условий. Например, при высокой температуре и без доступа кислорода может произойти обратная реакция, при которой оксид металла образуется из бромида металла и брома.
Особенности реакции йода с оксидами металлов
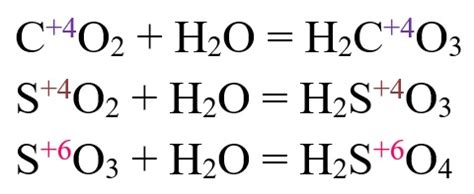
Реакция йода с оксидами металлов является одной из важных и особенных в химии. Йод, являющийся галогеном, проявляет свою способность к окислению и взаимодействию с оксидами металлов, что приводит к образованию соответствующих йодидов.
Процесс реакции йода с оксидами металлов обычно сопровождается выделением продуктов в виде йода и соответствующего оксида металла. Йод, как сильное окислительное вещество, окисляет металлический элемент в оксиде, превращая его в йодид, при этом сам йод превращается в йодид-ион. Таким образом, происходит образование новых химических соединений - йодида металла и йодида-иона.
В процессе реакции йода с оксидами металлов обычно наблюдается ярко выраженная окраска раствора в результате образования йодида. Также может быть выделено газообразное соединение, которое можно определить по его характерным запаху или цвету. Реакция йода с оксидами металлов может протекать при невысоких температурах, а также в присутствии катализаторов или добавления растворителей.
Особенностью реакции йода с оксидами металлов является возможность использования полученных йодидов и йодид-ионов в различных областях. Например, йодиды металлов находят применение в фотографии, медицине, производстве электроники и других отраслях индустрии. Благодаря своим уникальным химическим свойствам, йодиды металлов используются в качестве катализаторов, стабилизаторов, производителей электромагнитных материалов и других полезных веществ.
Практическое применение реакции галогенов с оксидами металлов

Реакция галогенов с оксидами металлов имеет широкое практическое применение в химической промышленности и в лабораторных условиях.
Одним из основных направлений применения этой реакции является получение галогенидов металлов. Галогениды представляют собой соли, в которых металл замещен галогеном. Эти соединения используются в различных областях, таких как металлургия, электроника, катализ. Например, хлорид железа (III) используется в процессе производства магнитных материалов, а бромид меди (II) применяется в химическом анализе.
Вторым важным применением этой реакции является получение диоксидов галогенов. Диоксиды галогенов находят применение в качестве окислителей, а также используются при производстве органических соединений. Например, хлорид диоксид используется в процессе синтеза карбоновых кислот и производства жидких кристаллов.
Также, в результате реакции галогенов с оксидами металлов образуются галогенокислоты. Эти соединения широко применяются в химической промышленности, фармацевтике и медицине. Галогенокислоты используются в процессе производства пластмасс, в качестве растворителей и дезинфицирующих средств, а также при производстве лекарственных препаратов.
Таким образом, реакция галогенов с оксидами металлов имеет важное практическое значение и находит широкое применение в различных областях. Она позволяет получать ценные продукты, которые используются в промышленности, научных исследованиях и повседневной жизни.
Вопрос-ответ

Каким образом галогены реагируют с оксидами металлов?
Галогены могут реагировать с оксидами металлов различными способами, в зависимости от условий реакции. Они могут образовывать с ними соли, оксигалогениды металлов или даже простые вещества.
Какие химические свойства галогенов позволяют им реагировать с оксидами металлов?
Галогены - это очень реакционные элементы, и их валентность может быть различной. Они обладают высокой электроотрицательностью, что позволяет им образовывать сильные химические связи с металлами, в том числе и с кислородом, содержащимся в оксидах металлов.
Какие могут быть возможные взаимодействия между галогенами и оксидами металлов?
Возможные взаимодействия между галогенами и оксидами металлов могут быть разнообразными. Например, хлор может реагировать с оксидами металлов, образуя хлориды металлов. Более активные галогены, такие как фтор, могут образовывать оксигалогениды металлов. Некоторые галогены могут также вступать в реакцию с оксидами металлов, освобождая кислород и образуя простые вещества.
Какие металлы чаще всего вступают в реакцию с галогенами?
Почти все металлы могут вступать в реакцию с галогенами. Однако, некоторые металлы более активные и реакционные, чем другие. Например, щелочные металлы (натрий, калий) и щелочноземельные металлы (магний, кальций) обычно хорошо реагируют с галогенами.
Какие эксперименты можно провести для изучения реакции галогенов с оксидами металлов?
Для изучения реакции галогенов с оксидами металлов можно провести несколько экспериментов. Например, можно добавить небольшое количество галогена к оксиду металла и наблюдать, какие продукты образуются. Также можно провести газовую хроматографию образовавшихся газов и проанализировать состав.
