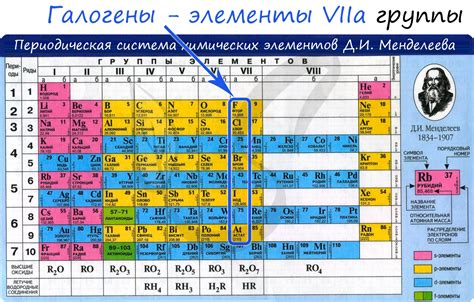
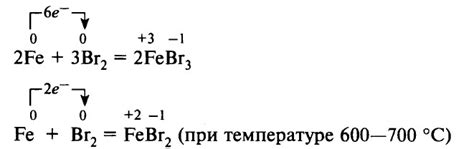Реакция галогенов с металлами является одной из важных химических реакций, результатом которой является образование солей. Галогены - это элементы группы VII периодической системы: фтор (F), хлор (Cl), бром (Br) и йод (I). Металлы, с которыми происходит реакция, могут быть как щелочными металлами, так и металлами переходных групп.
Галогены обладают высокой электроотрицательностью, что позволяет им легко отбирать электроны у металлов. При реакции галогена с металлом происходит образование ионов галогена и ионов металла. Ионы галогена, благодаря своей высокой электроотрицательности, образуют ионные связи с ионами металла, образуя соль.
Образование солей при реакции галогенов с металлами можно представить следующей формулой: галоген + металл = соль. Например, реакция хлора (Cl2) с натрием (Na) приводит к образованию натрия хлорида (NaCl), который является солью в виде белого кристаллического вещества.
Реакции галогенов с металлами широко используются в химической промышленности для получения различных солей. Соли, полученные из реакций галогенов с металлами, имеют широкое применение в различных отраслях промышленности, медицине и сельском хозяйстве.
Реакция галогенов с металлами
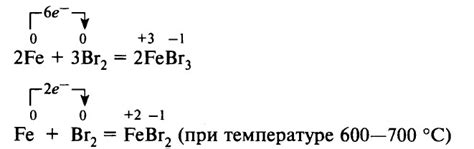
Реакция галогенов с металлами представляет собой процесс образования солей, которые широко используются в различных областях деятельности человека. Галогены – это элементы группы VII периодической системы, которые входят в состав химических соединений с различными металлами.
Один из примеров реакции галогенов с металлами – это образование хлоридов. Например, реакция хлора с натрием приводит к образованию хлорида натрия. Хлорид натрия широко применяется в пищевой промышленности, медицине и многих других отраслях.
Важной особенностью реакции галогенов с металлами является их активность и восприимчивость к реакциям с другими элементами. Например, хлор обладает высокой активностью и способен реагировать с многими металлами, образуя стабильные хлориды. Это обстоятельство часто используется в химическом анализе и синтезе соединений.
Реакции галогенов с металлами могут происходить как при повышенных температурах, так и при нормальных условиях. Некоторые реакции проходят с быстротой и высокой интенсивностью, что может приводить к выделению значительного количества тепла и света.
В заключение, реакция галогенов с металлами является важным процессом, позволяющим получить
Образование солей
Соли - это химические соединения, получаемые в результате реакции металлов с кислотами или галогенами. Образование солей происходит путем обмена ионами, при котором положительно заряженные ионы металлов соединяются с отрицательно заряженными ионами кислоты или галогена.
Реакция металлов с кислотами позволяет получить соли металлов и водород. Например, реакция цинка (Zn) с серной кислотой (H2SO4) приводит к образованию сульфата цинка (ZnSO4) и выделению водорода (H2).
Реакция галогенов с металлами также приводит к образованию солей. Например, реакция хлора (Cl2) с натрием (Na) приводит к образованию хлорида натрия (NaCl). Эта реакция широко используется в промышленности для получения поваренной соли.
Соли имеют широкое применение в различных областях, включая пищевую промышленность, химическую промышленность, медицину, сельское хозяйство и многие другие. Они используются как добавки в пищу, удобрения, лекарственные препараты, катализаторы и многое другое.
Вопрос-ответ

Какие галогены могут реагировать с металлами?
Галогены, такие как хлор, бром и йод, могут реагировать с металлами.
Что происходит при реакции галогенов с металлами?
При реакции галогенов с металлами образуются соли.
Каков механизм образования солей при реакции галогенов с металлами?
Механизм образования солей при реакции галогенов с металлами заключается в передаче электронов от металла к галогену, что приводит к образованию ионов металла и ионов галогена. Эти ионы соединяются, образуя соль.
Какие примеры можно привести реакции галогенов с металлами?
Примеры реакций галогенов с металлами включают реакцию хлора с натрием, при которой образуется хлорид натрия (NaCl), а также реакцию йода с железом, в результате которой образуется йодид железа (FeI2).