Химические реакции - это процессы, в результате которых происходят превращения веществ. Одной из таких реакций является взаимодействие фосфорной кислоты (H3PO4) с оксидом металла. Фосфорная кислота - это одна из наиболее распространенных кислот в химии, а оксиды металлов - это соединения, состоящие из кислорода и металла.
При взаимодействии H3PO4 с оксидом металла происходит образование соли и воды. В данной реакции фосфорная кислота действует как кислотный компонент, а оксид металла - как основание. В результате реакции образуется соль, которая состоит из катиона металла и аниона фосфорной кислоты. Таким образом, взаимодействие H3PO4 с оксидом металла можно рассматривать как протекание кислотно-основной реакции.
Примером такой реакции может служить взаимодействие H3PO4 с оксидом меди (CuO). В результате этой реакции образуется соль гидрофосфата меди (Cu(H2PO4)2) и вода.
Химические реакции являются основополагающими процессами во всей химии. Взаимодействие H3PO4 с оксидом металла представляет собой одну из многих возможных химических реакций, которые могут происходить в природе или быть искусственно синтезированными.
Взаимодействие H3PO4 с оксидом металла
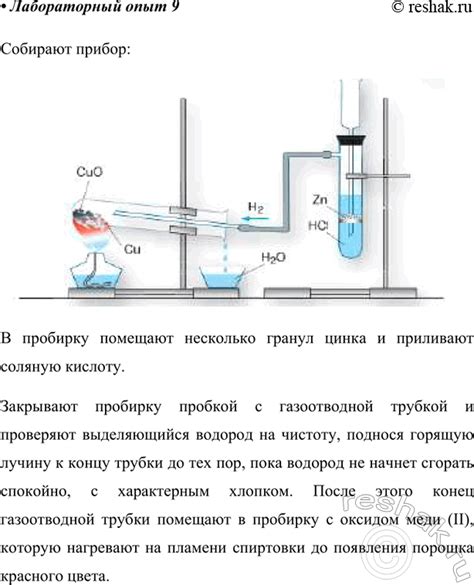
Химическая реакция, происходящая при взаимодействии фосфорной кислоты (H3PO4) с оксидом металла, является кислотной реакцией. В результате такой реакции образуется соединение - соль фосфорной кислоты и металла.
Фосфорная кислота (H3PO4) является трёхосновной кислотой, то есть содержит три замещённых атомами фосфора ионные группы. Когда эта кислота реагирует с оксидом металла, протолитические реакции происходят в результате, чего общая схема такой реакции представляется следующей:
- Выделив из фосфорной кислоты одни H+ и одни H2O молекулы, получаем фосфатную и ионную группу OH-
- Они образуют соединение, используя одну или несколько OH- соединений, в результате чего образуется сама соль
Примером такой реакции может служить взаимодействие фосфорной кислоты с оксидом металла алюминия (Al2O3):
- 2H3PO4 + Al2O3 → 2AlPO4 + 3H2O
В этом случае образуется фосфат алюминия (AlPO4) и молекулы воды (H2O). Похожие реакции могут происходить и с другими оксидами металлов, в зависимости от их свойств и химической активности.
Роль H3PO4 в химической реакции
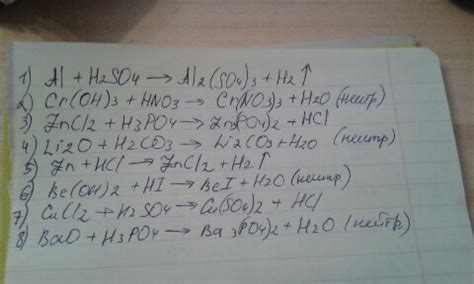
H3PO4 играет важную роль в химической реакции с оксидом металла. Она выступает в качестве кислотного компонента и участвует в образовании новых соединений.
В начале реакции, H3PO4 подвергается диссоциации, что означает, что она расщепляется на ионы. В результате образуются три иона водорода (H+) и один ион фосфата (PO4^3-).
В ходе реакции, ион фосфата вступает во взаимодействие с оксидом металла. Оксид металла содержит один или несколько атомов металла, соединенных с кислородом. При взаимодействии с ионом фосфата, образуется новое соединение - фосфат металла (MPO4), где M обозначает металл.
Реакция между H3PO4 и оксидом металла является реакцией нейтрализации, так как ионы водорода (H+) из H3PO4 реагируют с оксидом металла, уравновешивая его щелочные свойства. Таким образом, H3PO4 выступает в качестве кислоты, образуя новые соединения и реагируя с оксидом металла для образования фосфата металла.
Свойства оксида металла

Оксид металла представляет собой химичесное соединение, состоящее из кислорода и одного или нескольких металлов. Он обладает рядом характерных свойств, которые объясняют его широкое применение в различных отраслях промышленности.
Физические свойства:
- Оксид металла обычно является твёрдым веществом, но встречаются и жидкие оксиды.
- Он может иметь различные цвета, включая белый, черный, красный, желтый и другие.
- Оксид металла может быть нерастворимым в воде или растворимым лишь в определенных условиях.
Химические свойства:
- Оксид металла обладает высокой термической и химической стабильностью.
- Он может проводить электричество в твердом состоянии, но не в растворенном состоянии.
- Оксид металла может реагировать с кислотами, образуя соли и выделяя воду.
Применение оксида металла:
- Он используется в производстве различных материалов, например, керамики и смол.
- Оксид металла может быть использован в качестве катализатора для различных химических реакций.
- Он применяется в производстве электронных компонентов, таких как полупроводниковые материалы и керамические конденсаторы.
Таким образом, оксид металла обладает разнообразными свойствами, которые делают его полезным в различных отраслях промышленности. Его химическая реакция с кислотами, включая H3PO4, может приводить к образованию солей и выделению воды.
Процесс взаимодействия H3PO4 с оксидом металла

H3PO4 (ортофосфорная кислота) – химическое соединение, состоящее из трех молекул воды и молекулы фосфорной кислоты. Она является довольно сильным кислотным соединением и реагирует с многими оксидами металлов. Взаимодействие H3PO4 с оксидом металла происходит с образованием соли фосфорной кислоты и воды.
Процесс взаимодействия осуществляется по следующей реакции:
H3PO4 + MO → M(H2PO4) + H2O,
где M - металл, а M(H2PO4) - соль фосфорной кислоты с металлом M.
Реакция H3PO4 с оксидом металла является реакцией нейтрализации. Она протекает с выделением тепла и образованием соли фосфорной кислоты. Образование соли происходит путем замещения водородных ионов в H3PO4 на металлические ионы.
Процесс взаимодействия H3PO4 с оксидом металла может протекать как в твердой фазе, так и в растворе. При этом соли фосфорной кислоты образуются в виде твердых кристаллических соединений или в растворе с образованием ионов. Соли фосфорной кислоты являются важными химическими соединениями, применяемыми в различных отраслях промышленности.
Практическое применение реакции

Реакция взаимодействия H3PO4 с оксидами металлов находит широкое применение в различных отраслях науки и промышленности.
В химическом анализе реакция может использоваться для определения содержания оксидов металлов в различных материалах. Например, основываясь на известном соотношении реагентов и полученных продуктах реакции, можно определить концентрацию оксида металла в образце.
В промышленности реакция может быть полезной, когда требуется удалить оксиды металлов с поверхности изделий или оборудования. Например, при очистке металлических поверхностей от оксидов перед нанесением защитного покрытия, реакция H3PO4 с оксидами металлов помогает удалить их и обеспечить хорошую адгезию покрытия.
Также реакция находит применение в производстве удобрений и фосфатных соединений. H3PO4 является важным источником фосфора, который является необходимым питательным элементом для растений. В результате реакции с оксидами металлов получается фосфат, который затем может использоваться в качестве компонента удобрений.
И в конечном счете, реакция взаимодействия H3PO4 с оксидом металла является важным элементом в понимании основ химических реакций и их применения в различных областях науки и промышленности.
Вопрос-ответ

Имеет ли взаимодействие H3PO4 с оксидом металла какие-либо практические применения?
Да, взаимодействие H3PO4 с оксидом металла широко используется в различных промышленных процессах. Например, оксид металла может использоваться в качестве катализатора для реакции фосфорной кислоты соединениями органических веществ, такими как алкены. Это взаимодействие также может использоваться в процессе получения фосфорно-кислородных соединений, применяемых, например, в производстве удобрений или в качестве добавок к пищевым продуктам.
Как происходит взаимодействие H3PO4 с оксидом металла?
Взаимодействие H3PO4 с оксидом металла может происходить посредством ряда химических реакций. Одна из возможных реакций включает образование фосфата металла и воды, например: H3PO4 + MO → MPO4 + H2O, где M представляет собой металл. В зависимости от конкретных условий, таких как температура, давление и концентрация реагентов, могут образовываться различные продукты и сопутствующие соединения.
Какие металлы могут взаимодействовать с H3PO4?
H3PO4 может взаимодействовать с большим числом металлов. Некоторые из них включают алюминий, железо, медь, цинк, магний и никель. При этом взаимодействии образуются соответствующие фосфаты металла.
Возможно ли провести данную реакцию в домашних условиях?
Да, данную реакцию можно провести в домашних условиях с использованием химических реагентов, таких как H3PO4 и оксид металла. Однако необходимо соблюдать осторожность и использовать соответствующие меры безопасности, так как взаимодействие сильных кислот и оксидов может быть опасным.
