Фосфор – один из самых распространенных элементов на Земле, обладает уникальными химическими свойствами и широко применяется в различных отраслях науки и техники. Один из важных аспектов изучения фосфора – его взаимодействие с активными металлами и изменение степени окисления.
В процессе взаимодействия фосфора с активными металлами, такими как калий, натрий, литий и другие, происходит образование соединений различной природы. Например, особое внимание уделяется реакции фосфора с кислородом, в результате которой образуется фосфорная кислота или ее соли.
Изменение степени окисления фосфора при взаимодействии с активными металлами является важным показателем химической реакции. В зависимости от условий взаимодействия и степени окисления металла, фосфор может образовывать соединения с разными степенями окисления - от -3 до +5. Это отражает способность фосфора к различным окислительно-восстановительным реакциям и демонстрирует его высокую химическую активность.
Изменение степени окисления фосфора
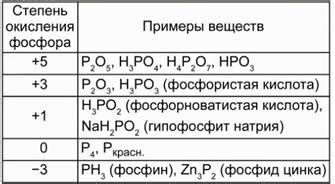
Фосфор является элементом, чья степень окисления в соединениях может изменяться. Он способен образовывать соединения с различными степенями окисления, такими как -3, +3, +5.
При взаимодействии фосфора с активными металлами происходит изменение его степени окисления. Например, при реакции с металлами группы 1 и 2 фосфор образует соединения с отрицательной степенью окисления (-3), такие как фосфиды. Эти соединения характеризуются высокой реакционной способностью и используются в качестве катализаторов и средств защиты от коррозии.
Также фосфор может образовывать соединения с степенью окисления +3, такие как фосфиты. Они применяются в качестве редукционных агентов и стабилизаторов окислительно-восстановительных процессов, а также в сельском хозяйстве в качестве пестицидов.
В основном фосфор образует соединения с степенью окисления +5, такие как фосфаты. Они являются основной формой фосфора в природе и широко используются в сельском хозяйстве в качестве удобрений. Фосфаты также входят в состав многих биологически активных веществ, таких как АДФ и АТФ, играющих важную роль в энергетическом обмене в клетках организмов.
Окисление и восстановление фосфора
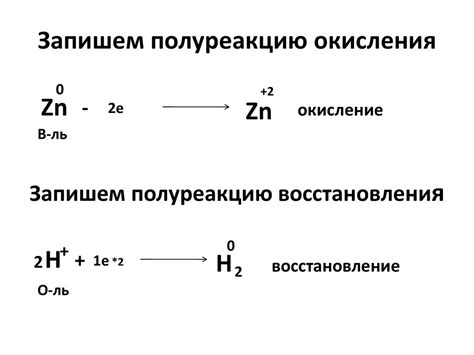
Одним из важных процессов в химии фосфора является его окисление и восстановление. Окисление - это процесс, при котором фосфор теряет электроны и повышает свою степень окисления. Восстановление, наоборот, заключается в принятии электронов и снижении степени окисления фосфора.
Окисление фосфора может происходить при контакте с активными металлами, такими как натрий, калий или магний. При этом фосфор получает кислород от металла и превращается в оксид фосфора. Например, при взаимодействии натрия с фосфором образуется оксид фосфора(III) - P4O6.
Восстановление фосфора обычно происходит с помощью водорода или других сильных восстановителей. Во время этого процесса фосфор принимает электроны и восстанавливается из оксидов фосфора к первоначальной степени окисления. Например, при взаимодействии фосфорного оксида(V) с водородом образуется фосфин - PH3.
Окисление и восстановление фосфора являются важными реакциями в различных химических процессах, включая синтез соединений фосфора, производство удобрений и фармацевтических препаратов. Понимание механизма этих реакций позволяет улучшить и оптимизировать процессы, связанные с фосфором, и найти новые применения для этого элемента.
Реакция фосфора с активными металлами

Фосфор вступает в реакцию с активными металлами, такими как натрий, калий и литий. Эта реакция является очень быстрой и сопровождается выделением значительного количества энергии. В результате реакции образуются фосфиды металлов.
Реакция фосфора с активными металлами происходит с выделением света и характеризуется особенной пирофорностью. При контакте с воздухом образовавшиеся фосфиды металлов могут гореть, что делает эту реакцию опасной. Поэтому необходимо соблюдать особую осторожность при обращении с фосфором и активными металлами.
Реакция фосфора с активными металлами происходит при повышенных температурах и является экзотермической, то есть сопровождается выделением тепла. При этом происходит окисление фосфора, который теряет электроны и переходит в более высокую степень окисления.
Изменение степени окисления фосфора в результате реакции с активными металлами имеет важное практическое значение. Фосфиды, образующиеся в результате таких реакций, находят применение в различных отраслях науки и техники, включая производство сплавов, катализаторов и электродов.
Таким образом, реакция фосфора с активными металлами является интересным и важным объектом изучения в химии. Взаимодействие этих веществ позволяет получать полезные соединения и находит широкое применение в различных отраслях промышленности и научных исследований.
Взаимодействие фосфора с кислородом

Фосфор представляет собой химический элемент, который легко взаимодействует с кислородом. В результате этого взаимодействия образуются разнообразные соединения, включая оксиды, гидрооксиды и кислородсодержащие группы в органических соединениях.
Основным оксидом фосфора является фосфорный(V) оксид (P2O5), который получается при полном сгорании фосфора на воздухе. Он представляет собой бесцветные кристаллы, обладающие высокой гигроскопичностью и реактивностью. Фосфорный(V) оксид используется в химической промышленности для получения фосфорной кислоты и других фосфорсодержащих соединений.
Фосфор также образует гидрооксиды взаимодействием с водой. Наиболее распространенным гидрооксидом фосфора является фосфорная(V) кислота (H3PO4). Она имеет многочисленные применения в промышленности, включая производство удобрений, красителей, синтетических смол и других химических соединений.
Фосфор c кислородом образует также кислородсодержащие группы в органических соединениях. Подобные группы могут иметь различные функциональные свойства и использоваться в разных областях. Например, эфиры фосфорной кислоты широко применяются в качестве растворителей, а фосфонаты используются в качестве стабилизаторов и антиоксидантов в пищевой промышленности.
Фосфороксиды и их свойства

Фосфороксиды - это соединения, состоящие из атомов фосфора и кислорода. Они обладают разнообразными физическими и химическими свойствами, что делает их важными в различных областях науки и технологии.
Одним из наиболее известных фосфороксидов является фосфорная кислота (H3PO4), которая широко используется в химической промышленности для производства удобрений, пищевых добавок и других продуктов. Это бесцветная жидкость с кислым вкусом и резким запахом. Фосфорная кислота обладает высокой растворимостью в воде и проявляет амфотерные свойства, то есть может действовать как кислота и основание в химических реакциях.
Другим важным фосфороксидом является фосфорит (Ca3(PO4)2), который является основным источником фосфора для производства удобрений. Фосфорит имеет низкую растворимость в воде и используется в виде примочек, как пищевой добавки и как сырье для получения фосфорных соединений.
Фосфороксиды также используются в медицине и фармацевтике. Например, оксидаль кальция (CaO) применяется в качестве антацида для лечения изжоги и кислотности желудка. Фосфаты кальция (Ca3(PO4)2) используются в качестве добавки в пищу для укрепления костей и зубов.
Свойства фосфороксидов могут меняться в зависимости от структуры, степени окисления фосфора и других факторов. Некоторые фосфороксиды обладают фотолюминесцентными свойствами, что позволяет использовать их в оптических устройствах и светоизлучающих материалах.
Таким образом, фосфороксиды представляют собой важные соединения с широким спектром свойств и применений. Изучение и понимание их химической природы и поведения имеет большое значение для развития науки и технологии.
Окислительные реакции фосфора с кислородом
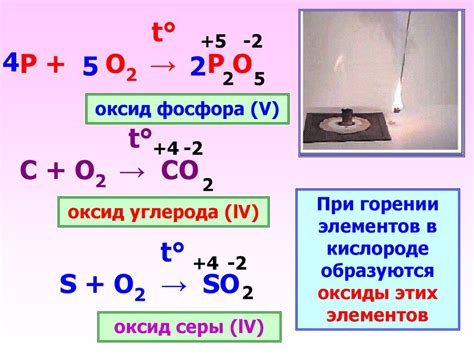
Фосфор является химическим элементом, который образует различные окислительные реакции с кислородом. Кислород вступает в реакцию с фосфором, изменяя его степень окисления и приводя к образованию соответствующих оксидов.
Одно из наиболее распространенных окислительных реакций фосфора с кислородом - образование оксида фосфора(III) (P2O3) и оксида фосфора(V) (P2O5). В первом случае, две молекулы фосфора соединяются с тремя молекулами кислорода, образуя два атома фосфора с окислением на +3. Во втором случае, три молекулы фосфора соединяются с пятью молекулами кислорода, образуя два атома фосфора с окислением на +5.
Фосфор также может образовывать оксиды с другими степенями окисления, например, оксид фосфора(I) (P4O10) и оксид фосфора(II) (P4O6). В первом случае, четыре молекулы фосфора соединяются с десятью молекулами кислорода, образуя два атома фосфора с окислением на +10. Во втором случае, три молекулы фосфора соединяются с шестью молекулами кислорода, образуя два атома фосфора с окислением на +3.
Окислительные реакции фосфора с кислородом описываются уравнениями, которые отражают изменение степени окисления фосфора и количество кислорода, вступающего в реакцию. Эти реакции имеют большое значение в различных процессах, включая синтез химических соединений, а также производство промышленных удобрений.
- Оксид фосфора(III) (P2O3): 4P + 3O2 → 2P2O3
- Оксид фосфора(V) (P2O5): 4P + 5O2 → 2P2O5
- Оксид фосфора(I) (P4O10): 8P + 10O2 → 4P4O10
- Оксид фосфора(II) (P4O6): 8P + 6O2 → 4P4O6
Таким образом, окислительные реакции фосфора с кислородом играют важную роль в химии и промышленности, образуя различные оксиды фосфора и позволяя получать разнообразные продукты с различными свойствами и применением.
Вопрос-ответ

Как происходит взаимодействие фосфора с активными металлами?
Взаимодействие фосфора с активными металлами происходит путем образования металлофосфидных соединений. В результате реакции, фосфор переходит в степень окисления -3. Это связано с тем, что активные металлы, такие как натрий или калий, обладают большей электроотрицательностью, чем фосфор. Поэтому они отдают свои электроны фосфору, что приводит к его окислению.
Какие активные металлы могут взаимодействовать с фосфором?
Реакция взаимодействия фосфора с активными металлами возможна с такими элементами, как натрий, калий, литий или магний. Эти элементы обладают достаточно низкой электроотрицательностью и способны отдавать электроны фосфору, что позволяет происходить превращению фосфора в соединения с металлом.
В какой степени окисления находится фосфор после взаимодействия с активными металлами?
После взаимодействия фосфора с активными металлами, фосфор переходит в степень окисления -3. Это связано с тем, что активные металлы обладают большей электроотрицательностью и отдают свои электроны фосфору, что приводит к его окислению.
