Взаимодействие CuCl2 и Fe является одним из классических примеров реакции между металлом и солью. Однако, в данном случае, не происходит выделения металла, что является неожиданным и интересным явлением.
Для начала, следует рассмотреть структуру и химические свойства CuCl2 и Fe. CuCl2 представляет собой бинарное соединение меди и хлора, которое обладает кристаллической структурой и является хорошим окислителем. Железо (Fe) является металлом с характерными металлическими свойствами: высокая электропроводность, твердость, гибкость и т.д.
Однако, при взаимодействии CuCl2 и Fe не происходит выделения металла. Это можно объяснить тем, что основной реакцией при данной реакции является циклическая реакция, в которой медь переходит между двумя валентностями: Cu2+ и Cu+. При этом железо, находящееся в растворе, не образует стабильных соединений с медью и не выделяется в виде отдельных частиц.
Таким образом, отсутствие выделения металла при взаимодействии CuCl2 и Fe может быть объяснено циклической реакцией меди и отсутствием образования стабильных соединений между медью и железом. Это явление может быть использовано для проведения дополнительных исследований и экспериментов, направленных на изучение химических свойств данных веществ и установление механизма основной реакции.
Механизм взаимодействия CuCl2 и Fe
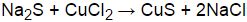
Взаимодействие между CuCl2 (хлоридом меди (II)) и Fe (железом) основывается на реакции окислительно-восстановительного характера, в результате которой происходит переход электронов между молекулами обоих веществ.
Сначала идет процесс окисления Fe, при котором Fe теряет электроны и переходит в состояние Fe2+ (железо (II)). В этот момент Cu2+ (медь (II)) принимает электроны от Fe и восстанавливается до Cu (меди). Таким образом, возникает Cu и Fe2+, которые образуют соединение FeCu (сплав).
Этот процесс можно представить следующей химической реакцией: Cu2+ + Fe → Cu + Fe2+
Для того, чтобы реакция могла протекать, нужны определенные условия, такие как наличие электролита (например, соли), растворимость соединений в воде и наличие электродов, которые будут участвовать в переносе электронов.
Данное взаимодействие является одним из примеров реакции дисплейсментa, когда один металл вытесняет другой из раствора его соли. В данном случае медь вытесняет железо из его соединения с хлором.
Итак, механизм взаимодействия CuCl2 и Fe связан с процессом окисления и восстановления, в результате которого образуется сплав FeCu. Этот процесс широко используется в промышленности, где сплавы используются для изготовления различных металлических изделий с желаемыми свойствами.
Способы продления срока службы телефона

В настоящее время мобильные телефоны являются неотъемлемой частью нашей жизни. Они не только позволяют нам оставаться на связи, но и выполняют множество других функций, таких как использование различных приложений, просмотр видео и фотографий, доступ в интернет и многое другое. Однако со временем производительность телефона может снижаться, а его батарея начинает быстро разряжаться.
Популярным способом продления срока службы телефона является оптимизация его работы. Для этого можно отключить неиспользуемые приложения, отключить автоматическую синхронизацию данных, установить энергосберегающие режимы, ограничить использование фоновых процессов и т.д. Это позволит увеличить время автономной работы телефона и улучшить его производительность.
Также важно следить за состоянием батареи и правильно ее заряжать. Для этого рекомендуется использовать оригинальное зарядное устройство и избегать перезарядки и перегрева батареи. Также полезно регулярно проверять и чистить разъемы зарядки, чтобы избежать появления неполадок.
Помимо этого, для продления срока службы телефона можно использовать специальные аксессуары. Например, наклейки-аккумуляторы позволяют увеличить емкость батареи телефона и значительно увеличить время его работы без подзарядки. Также существуют портативные зарядные устройства, которые позволяют заряжать телефон в любом месте и в любое время.
Важно отметить, что правильный уход и содержание телефона также влияют на его срок службы. Регулярная очистка от пыли и грязи, защита от механических повреждений, использование защитных чехлов и пленок помогают сохранить и продлить жизнь телефона.
В итоге, для продления срока службы телефона необходимо оптимизировать его работу, следить за состоянием и правильно заряжать батарею, использовать специальные аксессуары и обеспечивать правильный уход и защиту устройства. Это позволит максимально использовать возможности телефона и продлить его срок службы.
Последствия отсутствия выделения металла при взаимодействии CuCl2 и Fe

Отсутствие выделения металла при взаимодействии CuCl2 и Fe может иметь ряд серьезных последствий. Во-первых, это может свидетельствовать о нарушении реакции окисления-восстановления, что может привести к неправильным результатам или невозможности получения нужного продукта.
Кроме того, отсутствие выделения металла может означать недостаточное количество реактивов или их неправильное соотношение. Это может говорить о неправильной подготовке реакционной смеси или использовании некачественных реагентов. В таких случаях, необходимо проверить правильность подготовки реакционной смеси и качество используемых реагентов.
Другим возможным объяснением отсутствия выделения металла может быть ненадлежащая реакционная среда. Например, не все реакции происходят в воде, некоторые требуют наличия специальных растворителей или изменения pH среды. Поэтому, стоит проверить правильность использования реакционной среды и при необходимости внести коррективы.
Наконец, отсутствие выделения металла может также быть связано с недостаточной реакционной активностью. Некоторые металлы могут быть менее активными при взаимодействии с определенными реагентами или в определенных условиях. В таких случаях, необходимо проанализировать причины и попытаться изменить условия или заменить реагенты, чтобы достичь нужного результата.
Альтернативные способы защиты металлов

Металлы подвержены воздействию окружающей среды, что может приводить к их коррозии и потере свойств. Для защиты металлов от разрушительных процессов разрабатываются различные методы и технологии.
Пассивация – один из способов защиты металлов, заключающийся в создании пассивного слоя на поверхности материала, который предотвращает его взаимодействие с окружающей средой. Данный слой может быть образован естественным путем, например, под воздействием атмосферного кислорода, или при помощи специальных химических реакций и обработок.
Электролитическая защита – основана на принципе использования электродных потенциалов для создания защитного слоя на поверхности металла. При этом проводится электролиз, в результате которого на поверхности обрабатываемого металла образуется оксидный слой, предотвращающий коррозию.
Использование специальных покрытий – еще один способ защиты металлов от коррозии. Например, металлы могут быть покрыты различными нано- и микрошкалами, которые создают защитный слой на поверхности материала и предотвращают его взаимодействие с воздухом и влагой.
Ингибиторы коррозии – это вещества, которые добавляются к окружающей среде или покрытиям, чтобы предотвратить процесс коррозии металла. Ингибиторы коррозии образуют на поверхности металла защитный слой, который замедляет или полностью останавливает процесс коррозии.
Каждый из этих способов имеет свои особенности и применяется в зависимости от конкретных условий эксплуатации металлических конструкций и их предназначения. Выбор оптимального метода защиты позволяет продлить срок службы металла, сохранить его физические и химические свойства, а также снизить затраты на ремонт и обслуживание.
Исследование реакции CuCl2 и Fe
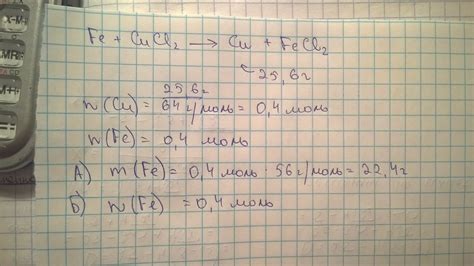
Исследование реакции между раствором CuCl2 и металлом железа (Fe) позволяет изучить процесс взаимодействия этих веществ и определить наличие или отсутствие выделения металла.
Эксперимент проводится путем добавления металлического железа в раствор CuCl2. В данной реакции образуются соединения меди и железа: CuFeCl4 и CuCl2. Это связано с тем, что медь более активный металл, чем железо, и соразмерно реагирует с хлоридами.
Однако, при исследовании данной реакции не наблюдается выделение металла железа. Это объясняется тем, что полученное соединение CuFeCl4 является растворимым в воде. Таким образом, металл железа не выделяется в виде осадка или выпадения, а остается в растворе в виде ионов.
Такое поведение связано с различными степенями активности меди и железа. Железо, являясь менее активным металлом, не может вытеснить медь из ее соединений, поэтому не происходит образование осадка или выделение металла. Данное исследование подтверждает термодинамические свойства реакции и связанные с ними химические принципы.
Применение реакции CuCl2 и Fe в промышленности

В промышленности реакция между CuCl2 и Fe может быть использована в различных областях. Например, медные соли, такие как CuCl2, могут использоваться в производстве различных медных сплавов с целью улучшения их механических свойств.
Реакция между CuCl2 и Fe также может быть применена в производстве экологически чистых аккумуляторных батарей. При такой реакции между медными солями и железом происходит образование комплексных соединений, которые могут быть использованы в качестве активных материалов в аккумуляторах.
Кроме того, реакция между CuCl2 и Fe может быть использована в процессе химического осаждения. Железо является более активным металлом, чем медь, поэтому при взаимодействии медных солей с железом происходит осаждение железа. Этот процесс может быть использован в производстве поверхностей с медным покрытием, которые обладают повышенной стойкостью к коррозии и имеют эстетическое привлекательное покрытие.
Также реакция CuCl2 с Fe может использоваться при производстве катализаторов. Катализаторы на основе медных соединений и железа могут играть важную роль в различных химических реакциях, включая процессы газификации и синтеза аммиака. Они способны ускорить химические реакции и повысить их эффективность.
Вопрос-ответ

Почему при взаимодействии CuCl2 и Fe не происходит выделения металла?
При взаимодействии CuCl2 (хлорида меди (II)) и Fe (железа) не происходит выделения металла потому, что железо находится в более низкой электрохимической серии, чем медь, и не способно вытеснить ее из раствора.
Возможно ли выделение металла при взаимодействии CuCl2 и Fe?
Нет, при взаимодействии CuCl2 (хлорида меди (II)) и Fe (железа) выделение металла не происходит. Это связано с тем, что железо находится ниже меди в ряду электрохимической активности металлов, поэтому оно не может вытеснить медь из раствора.
Каковы причины отсутствия выделения металла при взаимодействии CuCl2 и Fe?
При взаимодействии CuCl2 (хлорида меди (II)) и Fe (железа) отсутствие выделения металла обусловлено тем, что Fe находится ниже Cu в ряду напряжения электродов и имеет более низкую электрохимическую активность. Это означает, что Fe не способно вытеснить медь из раствора и происходит обратная реакция, в результате которой Fe переходит в ионное состояние.
