Азотная кислота – одно из важнейших химических соединений, которое находит широкое применение в различных отраслях промышленности и научных исследованиях. Ее влияние на взаимодействие с металлами основной группы является предметом многолетних исследований и представляет большой интерес для химиков и материаловедов.
Известно, что азотная кислота может проявлять как окислительные, так и восстановительные свойства при взаимодействии с металлами основной группы. В своей окислительной форме она может образовывать оксиды металлов, при этом способствуя их окислению и превращению в соединения с более высокой степенью окисления. В свою очередь, восстановительные свойства азотной кислоты позволяют превращать соединения металлов в более низкую степень окисления, что может быть полезно, например, при производстве металлов.
Кроме того, азотная кислота может исполнять роль катализатора при взаимодействии металлов с другими веществами. В некоторых случаях она способна активировать металлы и инициировать реакции, которые иначе были бы медленными или невозможными. Это делает азотную кислоту важным инструментом в химической промышленности и научных исследованиях, где ее применение может привести к созданию новых материалов и технологий.
Влияние азотной кислоты на химическое взаимодействие с металлами
Азотная кислота (HNO3) – это одна из самых широко используемых кислот в химической промышленности. Ее влияние на химическое взаимодействие с металлами основной группы является значительным и перспективным.
Азотная кислота обладает высокой окислительной активностью, что позволяет ей эффективно взаимодействовать с различными металлами. В процессе реакции азотная кислота окисляет металлы, образуя соответствующие нитраты. Данное взаимодействие основных металлов с азотной кислотой может быть использовано для получения широкого спектра продуктов, применяемых в различных областях науки и промышленности.
Процесс взаимодействия азотной кислоты с металлами может происходить в различных условиях и с разной скоростью. Влияние различных факторов, таких как концентрация азотной кислоты, температура и давление, может существенно модифицировать характер и химические свойства образующихся продуктов. Данные факторы также могут оказывать влияние на скорость реакции и процент выхода целевого продукта.
Стоит отметить, что одним из главных преимуществ взаимодействия азотной кислоты с металлами является его высокая степень стереоселективности. Это означает, что реакция протекает с высокой степенью выбора определенной стереохимической формы молекулы, что может быть весьма полезным при синтезе сложных органических соединений.
Реакции металлов основной группы с азотной кислотой
Азотная кислота (HNO3) является одним из наиболее распространенных химических соединений, используемых в индустрии и обычной жизни. Она является сильным окислителем и способна реагировать с большим числом веществ, включая металлы основной группы.
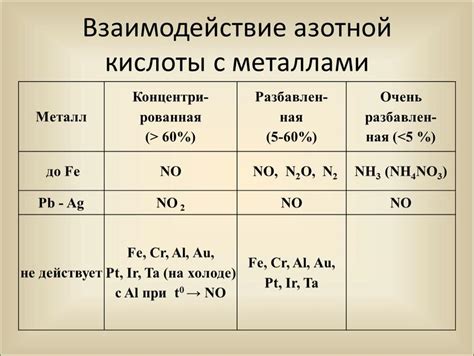
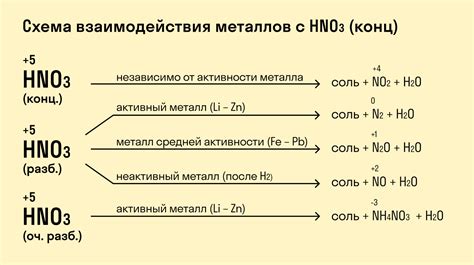
Большинство металлов основной группы проявляют реакцию с азотной кислотой, хотя ее сила и скорость зависят от концентрации и температуры реакции. Реакции металлов с азотной кислотой могут протекать с образованием оксидов металлов и выделением оксидов азота.
Например, при взаимодействии натрия (Na) с азотной кислотой образуется нитрат натрия (NaNO3) и оксид азота (NO). Цинк (Zn) также может реагировать с азотной кислотой, образуя нитрат цинка (Zn(NO3)2) и выделяяся оксиды азота.
Металлы основной группы могут быть разделены на две группы в зависимости от их способности реагировать с азотной кислотой. Металлы первой группы, такие как натрий, калий и литий, реагируют с азотной кислотой очень быстро и интенсивно, образуя нитраты и оксиды азота. Металлы второй группы, такие как цинк, магний и алюминий, реагируют с азотной кислотой медленнее и образуют нитраты и оксиды азота, но реакция протекает менее интенсивно.
Реакции металлов основной группы с азотной кислотой являются важными с точки зрения промышленного производства и использования этих веществ. Эти реакции могут быть использованы для получения нитратов и других соединений металлов, а также для исследования химических свойств и поведения металлов в различных условиях.
Образование нитратов металлов под действием азотной кислоты
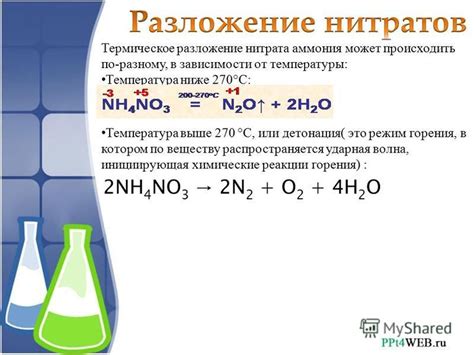
Азотная кислота (HNO3) является сильной кислотой и обладает высокой окислительной активностью. Под влиянием этой кислоты металлы основной группы могут образовывать нитраты - соли азотной кислоты. Нитраты металлов широко применяются в различных промышленных и научных сферах благодаря своим уникальным свойствам и широкому спектру применения.
В процессе взаимодействия азотной кислоты и металлов основной группы, происходит окислительно-восстановительная реакция. Азотная кислота действует как окислитель, передавая кислородные атомы на металлы. Это позволяет металлам изменять свою валентность и образовывать нитраты.
Химический состав и свойства нитратов металлов зависят от исходного металла и условий реакции. Например, нитраты некоторых металлов, таких как нитрат натрия (NaNO3) и нитрат калия (KNO3), имеют высокую растворимость в воде и находят широкое применение в производстве удобрений и пиротехники. Другие нитраты, например нитрат свинца (Pb(NO3)2), обладают низкой растворимостью и используются в качестве пигментов и стабилизаторов в производстве красок и лаков.
Образование нитратов металлов под действием азотной кислоты является важным процессом в химической промышленности и научных исследованиях. Изучение данного взаимодействия позволяет расширить сферу применения нитратов и разрабатывать новые материалы с улучшенными свойствами и характеристиками.
Использование нитратов металлов в промышленности и быту

Нитраты металлов широко используются как удобные источники азота в промышленных процессах. Например, нитрат калия (KNO3) используется в производстве взрывчатых веществ, пиротехники и удобрений. Он является основным компонентом солей, которые используются для создания газовых эффектов и ярких цветов в пиротехнических изделиях.
Нитраты металлов также находят применение в быту. Например, нитрат натрия (NaNO3) используется в пищевой промышленности в качестве добавки E251, а также в производстве мясных продуктов, солений и консервов. Он является эффективным консервантом, особенно для мяса, так как обладает антибактериальными свойствами.
Кроме того, нитраты металлов находят применение в производстве стекла. Например, нитрат натрия используется для придания стеклу особой прозрачности и прочности. Кроме того, нитраты металлов используются в процессе нитратного солевого выжигания, который является одним из методов получения высококачественных металлических порошков.
Таким образом, нитраты металлов играют важную роль в промышленности и быту, найдя применение в производстве взрывчатых веществ, пиротехники, удобрений, пищевой промышленности, производстве стекла и получении металлических порошков. Их использование способствует улучшению качества и функциональности различных продуктов и материалов, а также повышению их долговечности и безопасности.
Вопрос-ответ

Как азотная кислота взаимодействует с металлами основной группы?
Азотная кислота может взаимодействовать с металлами основной группы, образуя нитраты. Это происходит путем окисления металла азотной кислотой и образования ионов нитрата.
Какое влияние оказывает азотная кислота на металлы основной группы?
Азотная кислота может коррозировать и разрушать металлы основной группы из-за своей окислительной природы. Она может вызывать окисление металлов и образование оксидных пленок, что приводит к их разрушению.
