Азотная кислота (HNO3) – одна из самых распространенных и важных кислот в химии. Она является сильным окислителем и реагирует с многими веществами, включая металлы. Взаимодействие азотной кислоты с металлами является классическим примером реакции окисления-восстановления.
Азотная кислота обладает высокой реакционной способностью благодаря наличию в ее составе атомов кислорода и безводного азота. Когда азотная кислота контактирует с металлом, происходит окисление металла и выделение газообразного продукта — оксида азота (NO), который приводит к образованию характерной коричневой дымащейся пары. Это явление называется азотированием.
Взаимодействие азотной кислоты с металлами имеет практическое значение в многих отраслях промышленности. Например, азотная кислота используется для очистки поверхности металлов перед нанесением покрытий, так как она способна удалить окислы и другие загрязнения с поверхности металла. Кроме того, азотная кислота используется в процессе получения азотных соединений и удобрений.
Равновесие азотной кислоты и металлов
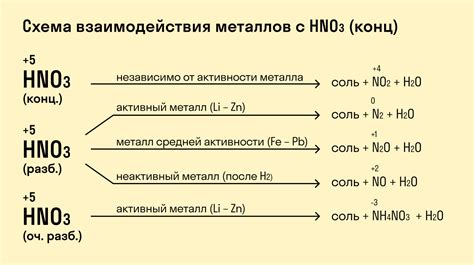
Равновесие азотной кислоты и металлов представляет собой важный аспект взаимодействия этих двух веществ. Азотная кислота (HNO3) является сильной кислотой, образующей радикальные ионы NO3-. Металлы, в свою очередь, обладают различной реакционной способностью в зависимости от своей химической природы. Реакция азотной кислоты с металлами может протекать по разным механизмам, включая образование солей и выделение газа.
В зависимости от условий, равновесие между азотной кислотой и металлами может быть сдвинуто в одну или другую сторону. Использование различных катализаторов, изменение температуры и концентрации реагентов могут оказывать влияние на скорость реакции и направление перехода веществ в равновесное состояние.
Важно отметить, что при взаимодействии азотной кислоты с металлами может образовываться хлориды, бромиды и йодиды металлов, если кислота содержит соответствующие кислоты галогенов. Эти соли могут обладать различными физическими и химическими свойствами и использоваться в различных промышленных процессах.
Таким образом, равновесие азотной кислоты и металлов является комплексным процессом, который может быть продуктивно изучен и использован в различных областях науки и технологии. Дальнейшие исследования данного равновесия могут привести к разработке новых методов синтеза и улучшению существующих химических процессов.
Взаимодействие азотной кислоты

Азотная кислота (HNO3) – химическое соединение, широко используемое в промышленности и научных исследованиях. Она представляет собой сильную кислоту, которая обладает высокой реакционной способностью и возможностью тонкого взаимодействия с различными веществами, включая металлы.
Взаимодействие азотной кислоты с металлами происходит при образовании нитратов. Данное химическое реактивное взаимодействие называется окислением. Азотная кислота при этом выступает в роли окислителя, а металл – в роли восстановителя. В результате образуется соединение, в котором атом азота приобретает положительный заряд, а металл превращается в ион с отрицательным зарядом.
Примеры взаимодействия азотной кислоты с металлами:
- Азотная кислота и железо образуют железнокислый нитрат.
- Серебро при взаимодействии с азотной кислотой образует серебряный нитрат.
- Взаимодействие азотной кислоты с медью приводит к образованию медного нитрата.
Также взаимодействие азотной кислоты с металлами может происходить с образованиемзапятую Нитридо-металловых соединений. Например, взаимодействие азотной кислоты с белилом дает нитрид азота(II) или растворимый в воде азотистую кислоту.
Металлы в химии азотной кислоты
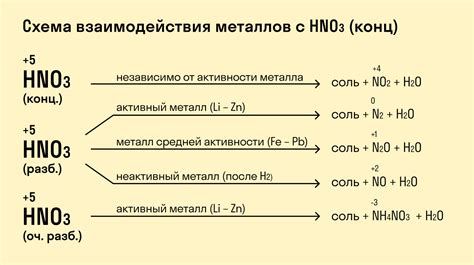
Азотная кислота (HNO3) является одной из самых активных химических соединений, которая может взаимодействовать с различными металлами. Взаимодействие азотной кислоты с металлами способно вызвать различные химические реакции и может быть использовано в различных промышленных процессах.
Азотная кислота может реагировать с металлами, образуя нитраты, которые являются химическими соединениями металла с азотной кислотой. Нитраты обладают широкими применениями в промышленности, сельском хозяйстве и медицине, а также являются важными компонентами удобрений.
Взаимодействие азотной кислоты с металлами может привести к различным эффектам. Некоторые металлы могут растворяться в азотной кислоте, образуя нитратные и нитрозные соединения. Другие металлы могут реагировать с азотной кислотой, образуя окисленные формы металла и выделение газа. Например, взаимодействие железа с азотной кислотой приводит к образованию фермина, выделяющего диоксид азота.
Некоторые металлы могут также катализировать окисление азотной кислоты, при этом образуется природный газ - азот. Например, платина и родий являются эффективными катализаторами этой реакции. Взаимодействие азотной кислоты с металлами является важной областью изучения в химии и имеет большое значение для понимания химических процессов и применения в различных отраслях промышленности.
Химические реакции металлов с азотной кислотой
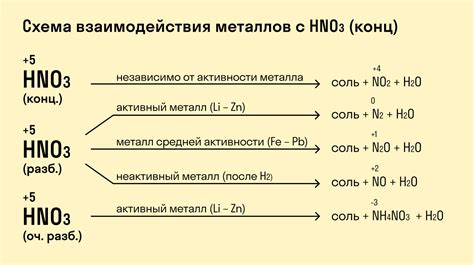
Азотная кислота является сильным окислителем и способна вступать в реакцию с различными металлами. В результате этих реакций образуются соответствующие нитраты металлов.
Одним из примеров реакции азотной кислоты с металлами является реакция с железом. При взаимодействии азотной кислоты с железом происходит окисление железа до двухвалентного состояния, а азотная кислота восстанавливается до оксида азота(IV). В результате образуется нитрат железа(II):
4Fe + 10HNO3 → 4Fe(NO3)2 + NH4NO3 + 3H2O
Кроме железа, азотная кислота вступает в реакцию с другими металлами, например, с медью. В данном случае происходит окисление меди до двухвалентного состояния, а азотная кислота восстанавливается до оксида азота(IV). Образуется нитрат меди(II):
2Cu + 8HNO3 → 2Cu(NO3)2 + 4NO2↑ + 2H2O
Такие реакции можно использовать для получения нитратов металлов, которые находят применение в различных отраслях промышленности, в том числе в производстве удобрений и взрывчатых веществ.
Окислительные свойства азотной кислоты в образовании металлических оксидов
Азотная кислота, также известная как кислота азотной серы, является мощным окислителем и обладает способностью эффективно взаимодействовать с различными металлами. В процессе этого взаимодействия образуется металлический оксид.
Окислительные свойства азотной кислоты объясняются наличием атомов кислорода и переменной степени окисления азота в ее структуре. Азотная кислота может отдавать кислородные атомы и принимать электроны от металла, что в конечном итоге приводит к окислению металла и образованию металлического оксида.
Процесс окисления металла азотной кислотой может происходить как в водном растворе, так и в паровой фазе. При этом различные металлы реагируют с азотной кислотой по-разному и образуют оксиды с различными степенями окисления.
Образование металлического оксида в результате взаимодействия азотной кислоты с металлом может иметь важные практические применения. Например, окисление металлов азотной кислотой может использоваться в химическом производстве для получения металлических оксидов, которые являются важными компонентами для создания различных материалов, катализаторов и добавок для создания специальной структуры и свойств экспериментальных материалов.
Коррозия металлов под воздействием азотной кислоты

Коррозия - это процесс разрушения металлической поверхности под воздействием окружающей среды. Одним из агрессивных веществ, способных вызывать коррозию, является азотная кислота (HNO3).
Азотная кислота обладает высокой окислительной активностью и способна активно взаимодействовать с металлами. Под влиянием азотной кислоты металлы могут растворяться и образовывать коррозионные нанесения на своей поверхности.
Процесс коррозии металлов под воздействием азотной кислоты обусловлен взаимодействием между металлом и кислотой. При этом азотная кислота окисляет металл, переходя в другие соединения и выделяя продукты коррозии.
Из всех металлов особенно подвержены коррозии под воздействием азотной кислоты активные металлы, такие как железо, алюминий и цинк. Пассивные металлы, например, нержавеющая сталь, медь и свинец, могут быть устойчивы к коррозии в некоторых условиях, однако длительное воздействие азотной кислоты все равно может привести к коррозии и разрушению металлической поверхности.
Окружающая среда, в которой находится металлический предмет, также может оказывать влияние на процесс коррозии под действием азотной кислоты. Например, высокая влажность воздуха, наличие других агрессивных веществ или высокая температура могут усиливать коррозионные процессы.
В целом, коррозия металлов под воздействием азотной кислоты является серьезной проблемой, так как может привести к потере функциональных и эстетических характеристик металлических изделий и конструкций. Поэтому важно применять защитные покрытия и правила эксплуатации, которые позволяют уменьшить воздействие азотной кислоты на металлы и предотвратить коррозию.
Применение азотной кислоты и металлов в промышленности и науке
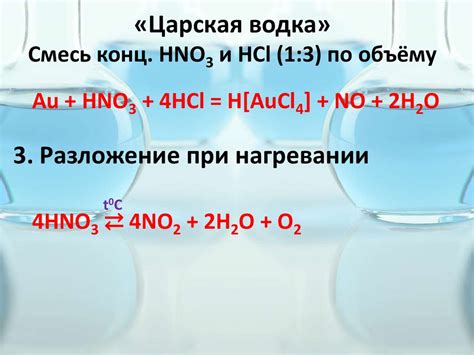
Азотная кислота является одним из наиболее важных химических соединений, применяемых в промышленности и науке. Она широко используется в производстве удобрений, в процессе окисления металлов и как катализатор в органическом синтезе.
В промышленности азотная кислота играет ключевую роль в производстве азотных удобрений. Она является основным сырьем при производстве аммиака, который затем используется для синтеза азотных удобрений, таких как аммофос и карбамид.
Азотная кислота также применяется в процессе окисления металлов, таких как железо и медь. Этот процесс называется азотножирное осаждение и позволяет получить пленки из оксида металла с повышенной твердостью и износостойкостью. Такие пленки применяются в производстве электронных компонентов, например, для защиты контактных поверхностей от окисления.
В науке азотная кислота используется как катализатор в органическом синтезе. Она способна активировать различные органические соединения, ускоряя реакцию и повышая выход целевого продукта. Применение азотной кислоты в органическом синтезе позволяет синтезировать сложные органические соединения с высокой степенью чистоты.
Вопрос-ответ

Какая роль азотной кислоты во взаимодействии с металлами?
Азотная кислота может действовать как окислитель или как редуктор при взаимодействии с металлами. В зависимости от условий реакции и свойств металла, азотная кислота может окислять металлы, образуя соответствующие соли, или быть восстановлена металлами, продуцируя аммиак и азотные оксиды.
Как взаимодействует азотная кислота с железом?
Азотная кислота, взаимодействуя с железом, приводит к образованию железных солей и освобождению аммиака. При этой реакции происходит окисление железа до более высоких степеней окисления и превращение азотной кислоты в окислительно-восстановительную кислоту, содержащую азотные оксиды.
