Азотная кислота, или азотная вода, обладает своеобразными свойствами при взаимодействии с металлами. Ее химическая формула HNO3 указывает на присутствие азота, водорода и кислорода. Эта неорганическая кислота является сильным окислителем и обладает довольно высокой реакционной способностью. Взаимодействие азотной кислоты с металлами не только вызывает частые химические превращения, но и имеет важное применение в различных отраслях промышленности и научных исследований.
Механизм реакции азотной кислоты с металлами определяется химическим свойством кислоты и структурой металла. При контакте с металлом азотная кислота выступает как окислитель, принимая на себя электроны из металла. Таким образом, азотная кислота окисляет металл, что приводит к образованию ионов металла с положительным зарядом. Полученные ионы металла могут образовать осадки или растворяться в реакционной среде, в зависимости от концентрации кислоты и других условий.
Применение реакции азотной кислоты с металлами находит широкое применение в промышленности и научных исследованиях. Одним из основных применений является получение растворов металлических солей, которые используются в качестве реагентов в различных процессах. Кроме того, реакция азотной кислоты с металлами позволяет получать оксиды металлов, которые могут использоваться в качестве катализаторов, пигментов и других функциональных материалов.
Одним из примеров использования реакции азотной кислоты с металлами является процесс пассивации нержавеющей стали. При взаимодействии азотной кислоты с поверхностью стали образуется пленка оксида хрома, которая предотвращает ржавление стали и увеличивает ее срок службы. Этот процесс широко применяется в производстве различных изделий и конструкций, для которых требуется высокая стойкость к коррозии.
Реакция азотной кислоты с металлами имеет важную роль в химических процессах, так как позволяет осуществлять контролируемые окислительные превращения металлов. Это особенно важно для получения определенных продуктов или изменения свойств материалов. Изучение механизма реакции и оптимизация условий проведения являются актуальными задачами научных исследований в области химии и материаловедения.
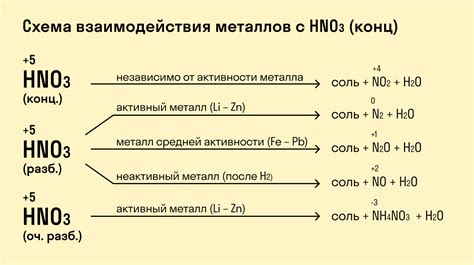
Реакция азотной кислоты с металлами

Азотная кислота (HNO3) является сильным окислителем и проявляет высокую реакционную активность при взаимодействии с металлами. Эта реакция широко изучена и имеет большое значение в химических процессах и практическом применении.
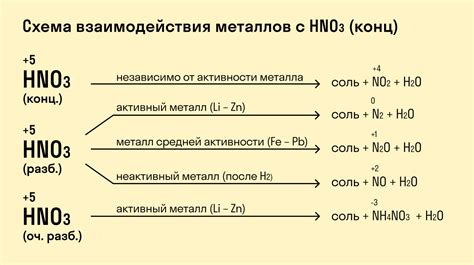
При взаимодействии азотной кислоты с металлами происходит окисление металла, сопровождающееся выделением азотного газа (NO). Механизм этой реакции состоит из двух этапов: сначала происходит образование нитрозильных и нитритных ионов, затем они окисляются до азотного газа.
Реакция азотной кислоты с металлами может использоваться для получения различных продуктов, таких как кислотные нитраты и их соли. Кислотные нитраты широко используются в промышленности для производства взрывчатых веществ, удобрений и других химических соединений.
Кроме того, реакция азотной кислоты с металлами играет важную роль в процессах каталитического окисления, особенно при использовании платиновых катализаторов. Азотная кислота может быть использована для удаления окисляемых загрязнений, таких как никель, свинец и другие металлы, из промышленных стоков.
Таким образом, реакция азотной кислоты с металлами является важным химическим процессом, который имеет широкое применение в различных отраслях промышленности и научных исследованиях. Ее изучение позволяет не только углубить понимание основных принципов химии, но и найти новые практические применения в различных областях науки и технологий.
Механизм реакции

Реакция азотной кислоты (HNO3) с металлами происходит по сложному механизму, который состоит из нескольких стадий.
На первой стадии происходит окисление металла азотной кислотой. Металл отдаёт электроны, превращаясь в положительный ион. Азотная кислота в эту реакцию вступает как окислитель, принимая эти электроны. Этот процесс называется окислительно-восстановительной реакцией.
На второй стадии образовавшийся положительный ион металла образует с анионами азотной кислоты соль, обычно нитрат. Таким образом, в результате реакции образуется вода и соль металла и нитрата.
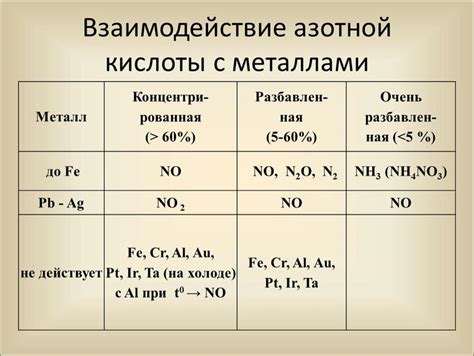
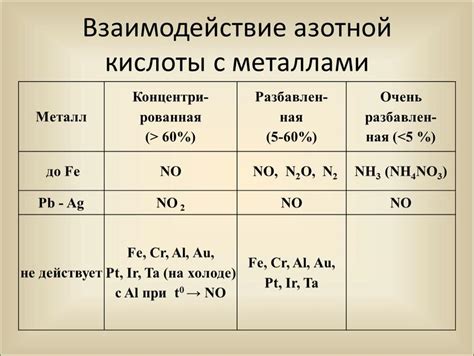
Из механизма данной реакции следует, что металлы могут реагировать с азотной кислотой только в том случае, если они обладают достаточной активностью для отдачи электронов. Из этого следует, что реакция азотной кислоты с металлами может протекать только с активными металлами, такими как калий, натрий или железо.
Применение азотной кислоты в реакциях с металлами
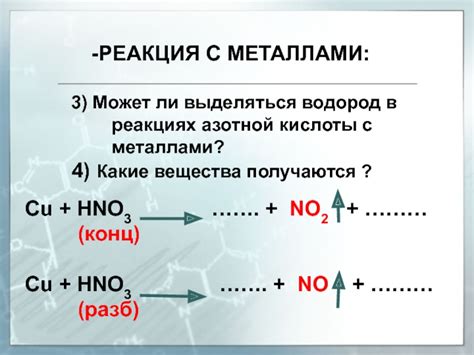
Азотная кислота (HNO3) широко применяется в химических процессах, в том числе и в реакциях с металлами. Она представляет собой сильную окислительную кислоту, способную передавать атомы кислорода. Благодаря этим свойствам азотная кислота находит применение в различных отраслях промышленности и научных исследованиях.
Одним из важных применений азотной кислоты является ее использование в качестве реагента при нитрировании органических соединений. В этом процессе атомы азота из азотной кислоты замещают атомы водорода в органических молекулах, что приводит к образованию нитрогрупп. Эта реакция имеет огромное значение в производстве взрывчатых веществ, красителей, фармацевтических препаратов и других органических соединений.
Азотная кислота также широко применяется для травления и проявления металлов. При контакте с металлической поверхностью азотная кислота реагирует с металлом, образуя растворимые нитраты. Этот процесс используется в металлургии, электронике и других промышленных отраслях для удаления окислов, загрязнений и поверхностных покрытий с металлических деталей.
Кроме того, азотная кислота находит применение в процессе обезжиривания металлов перед их напылением или нанесением защитных покрытий. Азотная кислота эффективно растворяет жир и древесные материалы, образующиеся на поверхности металла, что позволяет получить чистую поверхность для дальнейшей обработки.
Таким образом, азотная кислота играет важную роль в химических процессах, связанных с металлами. Ее применение в реакциях с металлами позволяет достичь различных целей, включая нитрирование органических соединений, травление и проявление металлов, а также обезжиривание металлических поверхностей.
Роль азотной кислоты в химических процессах с металлами

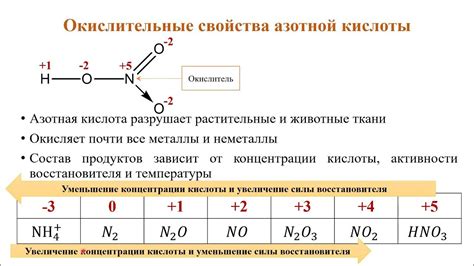
Азотная кислота, или HNO3, является сильным окислителем и активной кислотой, поэтому она играет важную роль во многих химических процессах, связанных с металлами. При взаимодействии с металлами азотная кислота может проявлять свойства окисления, растворения и образования соединений.
Окисление металлов азотной кислотой происходит путем передачи электронов. Азотная кислота принимает электроны от металла, при этом окисляя его. Это реакция окисления металла, которая может сопровождаться образованием окиси металла или ионов металла в растворе.
Растворение металлов в азотной кислоте может протекать в результате образования соответствующих солей. Азотная кислота реагирует с поверхностью металла, образуя соединения, которые растворяются в растворе. Это может привести к образованию нитратов металлов, которые обладают различными свойствами и могут быть использованы в различных областях промышленности.
Азотная кислота также играет важную роль в химических процессах, связанных с металлами, например, при очистке и обработке металлических поверхностей. В результате взаимодействия азотной кислоты с поверхностью металла происходит удаление окисленных слоев, нежелательных примесей и загрязнений, что позволяет получить чистую и гладкую поверхность металла.
Таким образом, азотная кислота играет важную роль во многих химических процессах, связанных с металлами. Ее свойства окисления, растворения и образования соединений позволяют использовать ее в различных областях промышленности, включая производство химических соединений, очистку металлических поверхностей и другие процессы.
Вопрос-ответ

Как происходит реакция азотной кислоты с металлами?
Реакция азотной кислоты с металлами происходит по следующему механизму. Сначала происходит диссоциация азотной кислоты на ионы HNO3: HNO3 -> H+ + NO3-. Затем ионы H+ реагируют с поверхностью металла, образуя ионы металла и воду: 2H+ + 2e- -> H2↑. Образовавшийся ион металла реагирует с ионами NO3-, образуя соответствующие соли металла: M+ + NO3- -> MNO3.
Для чего используется реакция азотной кислоты с металлами?
Реакция азотной кислоты с металлами имеет широкое применение в химических процессах. Например, она используется для получения солей металлов, которые далее могут использоваться в различных отраслях промышленности, таких как производство удобрений, лекарств или взрывчатых веществ. Кроме того, реакция азотной кислоты с металлами может служить методом анализа металлов, так как она позволяет определить наличие и концентрацию определенного металла в пробе.