Взаимодействие 22 г металла с кислотой является одной из важнейших реакций в химии. Кислота и металл сходятся в химическом противостоянии, при этом происходит образование газа – водорода. Объем полученного водорода позволяет установить количественный показатель этой реакции и вычислить количество металла, принимающего участие в процессе.
В данном случае, 22 г металла, вероятно, при взаимодействии с кислотой, образует 84 л водорода. Это свидетельствует о молекулярном весе данного металла и его активности в химических реакциях. Водород, образующийся при этом процессе, может быть использован в различных отраслях промышленности, а его количество является важным показателем для оценки экономической целесообразности взаимодействия металла с кислотой.
Подобные реакции являются основой многих химических процессов, таких как производство газовых баллонов, водородных топливных элементов, а также используются для определения количественного содержания металла в различных материалах. Взаимодействие 22 г металла с кислотой и образование 84 л водорода – это только один пример таких реакций, которые находят широкое применение в научной и промышленной практике.
Взаимодействие 22 г металла с кислотой

Взаимодействие 22 г металла с кислотой является химической реакцией, при которой происходит образование 84 л водорода. Эта реакция имеет большое практическое значение и используется в различных областях современной науки и техники.
Металл, который взаимодействует с кислотой и образует водород, может быть различным. Один из таких металлов - это магний. При реакции магния с кислотой образуется хлорид магния и водород. Эта реакция может протекать с различными кислотами, например, с соляной кислотой или серной кислотой.
Взаимодействие 22 г металла с кислотой происходит по реакции между металлом и кислотой. В этой реакции ионы металла переходят в раствор, а ионы водорода - выделяются в виде газа. Образование 84 л водорода говорит о том, что металл образует 2 моля водорода.
Взаимодействие металла с кислотой является одним из примеров химической реакции, которая сопровождается образованием газа. Это позволяет использовать такую реакцию для получения водорода, который имеет широкое применение в различных отраслях промышленности и науки. Также, взаимодействие металла с кислотой может быть использовано для обучения и исследования химических реакций в школе и университете.
Образование 84 л водорода

Металл 22 г взаимодействует с кислотой, в результате чего образуется 84 литра водорода. Водород (H2) – это безцветный газ, который является самым легким элементом в природе. Он обладает высокой горючестью и очень активен химически.
Водород образуется при реакции металла массой 22 г с кислотой. Водород может быть получен путем разных методов, но в данном случае он образуется в результате химической реакции между металлом и кислотой. Реакция происходит с выделением большого количества газа, и именно этот газ и является водородом.
84 литра водорода, образовавшиеся в результате данной реакции, можно использовать в различных областях. Водород широко применяется в промышленности, например, при производстве аммиака, метанола и других химических соединений. Он также используется в качестве топлива для водородных автомобилей и энергетических установок.
Образование 84 литров водорода в результате реакции металла с кислотой демонстрирует, каким образом химические реакции могут приводить к образованию новых веществ с уникальными свойствами. Водород – это важный и перспективный элемент в нашей жизни, который может быть использован в различных сферах деятельности.
Химический эксперимент

В химическом эксперименте было исследовано взаимодействие 22 г металла с кислотой, что привело к образованию 84 л водорода. Этот эксперимент является одним из способов исследования реакций между металлами и кислотами, а также позволяет измерять количество выделившегося водорода и оценить скорость реакции.
Исследование проводилось в контролируемом окружении, где точные измерения и наблюдения играют важную роль. В процессе эксперимента металл был помещен в колбу, в которую затем добавили кислоту. После взаимодействия между металлом и кислотой началось выделение водорода, который был накоплен в специальном сосуде для его дальнейшего измерения.
Эксперимент позволил установить, что взаимодействие 22 г металла с кислотой приводит к образованию 84 л водорода. Таким образом, можно сделать вывод, что в ходе реакции между металлом и кислотой происходит выделение водорода в соответствии с пропорциями реакции.
Исследование реакции между 22 г металла и кислотой имеет не только теоретическое значение, но и практическое применение. По полученным данным можно определить эффективность различных методов очистки металла, а также использовать их для получения водорода, который широко используется в различных отраслях промышленности и научных исследованиях.
Процесс отделения газа
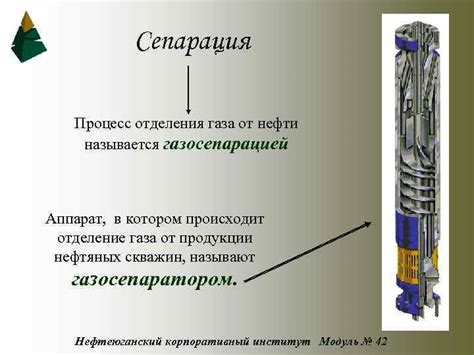
При взаимодействии 22 г металла с кислотой образуется 84 л водорода. Для эффективного отделения газа от реакционной смеси необходимо использовать специальное оборудование и следовать определенным процедурам.
В первую очередь необходимо подключить пробку с реакционной смесью к газоотводной трубке. Для этого следует убедиться, что пробка плотно закрыта и герметично установлена.
Затем необходимо присоединить газоотводную трубку к специальному сборнику, предназначенному для сбора и хранения газа. Следует убедиться в надежности и герметичности соединения, чтобы предотвратить утечки газа.
После подготовки оборудования можно приступить к отделению газа. Для этого необходимо аккуратно открыть кран на газоотводной трубке и дать газу свободно выходить в сборник. Желательно контролировать процесс отделения газа, чтобы избежать возможных проблем или аварийных ситуаций.
По завершению реакции и отделения газа необходимо закрыть кран на газоотводной трубке и аккуратно отсоединить ее от сборника. Готовый газ можно использовать для дальнейших исследований или других целей.
Основные характеристики реакции
Реакция взаимодействия 22 г металла с кислотой, в результате которого образуется 84 л водорода, представляет собой химическую реакцию, при которой происходит вывод гидрогена из соединения. Такой тип реакции называется реакцией замещения металла.
Один из основных признаков реакции является выделение водорода. В данной реакции образование 84 литров водорода подразумевает, что взаимодействие протекает полностью и эффективно. Образование газа свидетельствует о том, что происходит химическое превращение веществ.
Процесс взаимодействия металла с кислотой протекает с выделением энергии. Это можно сказать, изучая скорость реакции и изменение температуры окружающей среды. Если реакция происходит быстро и сопровождается повышением температуры, то можно сделать выводы о наличии экзотермической химической реакции.
Уравнение реакции может быть представлено следующим образом:
22 металла + кислота → соль + 84 л водорода
Соль, образующаяся в результате взаимодействия, может быть различной, в зависимости от вида использованной кислоты. Реакция может происходить с разными металлами, например, цинком, железом или алюминием. В каждом случае будет образовываться соответствующая соль.
Расчетные показатели
При проведении эксперимента по взаимодействию 22 г металла с кислотой и образованию 84 л водорода, необходимо рассчитать несколько показателей. Первым из них является массовая доля металла в реакционной смеси. Для этого необходимо знать массу металла, кислоты и общую массу смеси. Расчет проводится по формуле: массовая доля металла = (масса металла / общая масса смеси) * 100%.
Далее можно рассчитать расход реагента – кислоты. Расчет проводится по формуле: расход кислоты = масса металла / эквивалентная масса кислоты. Эквивалентная масса кислоты – это количество кислоты, соответствующее 1 эквиваленту активного металла. Она рассчитывается по формуле: эквивалентная масса кислоты = молярная масса кислоты / количество эквивалентов активного металла.
Для определения количества образовавшегося водорода используется формула Гей-Люссака. Согласно этой формуле, 1 эквивалент металла образует 1 эквивалент водорода. Это означает, что количество водорода равно количеству эквивалентов активного металла. Но в данном случае используется не эквивалент, а реальное количество образовавшегося водорода, поэтому нужно учесть объемную массу водорода – 84 л. Несложным уравнением можно определить массу водорода: масса водорода = объем водорода * плотность водорода.
Применение полученного водорода
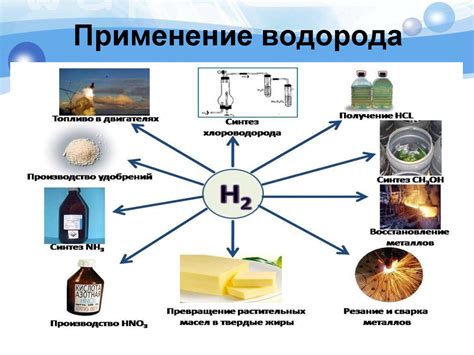
1. Водородная энергетика: Водород используется в качестве чистого источника энергии. Он может быть использован в топливных элементах, где водород и кислород с помощью катализаторов объединяются, производя электричество и воду как единственные отходы. Также водород может быть использован в водородных двигателях для привода транспортных средств.
2. Промышленные процессы: Водород используется в различных промышленных процессах. Например, водород может использоваться в процессе гидрогенизации, который позволяет преобразовывать жидкие или газообразные вещества, добавляя в них водород, что улучшает их характеристики.
3. Синтез аммиака: Водород используется в процессе синтеза аммиака, который является важной химической реакцией. Аммиак используется в производстве удобрений, пластмасс, взрывчатых веществ и других продуктов.
4. Пищевая промышленность: Водород может быть использован в пищевой промышленности для улучшения качества пищевых продуктов. Например, водород может быть использован в процессе гидрирования, чтобы увеличить время хранения пищевых масел.
5. Медицинская промышленность: Водород используется в медицине для различных процессов и процедур. Например, водород может быть использован в качестве анестезирующего газа или в газообразной форме для проведения клинических испытаний или диагностики.
В целом, полученный в результате взаимодействия 22 г металла с кислотой водород имеет широкий спектр применений в различных областях, что делает его ценным ресурсом. Использование водорода как альтернативного источника энергии поможет снизить зависимость от ископаемых ресурсов и снизить негативное влияние на окружающую среду.
Вопрос-ответ

Почему металл взаимодействует с кислотой?
Металл взаимодействует с кислотой из-за химической реакции между ионами металла и ионами водорода и кислотными ионами. В результате этой реакции образуется водородный газ.
Каков механизм образования водорода при взаимодействии металла с кислотой?
Механизм образования водорода при взаимодействии металла с кислотой связан с электрохимической реакцией. Когда металл погружается в кислоту, происходит окислительно-восстановительная реакция, в результате которой ионы металла окисляются, а протоны кислоты восстанавливаются, образуя молекулярный водород.
