Реакция металла с кислотой является одним из важных процессов в химии. Она основана на окислительно-восстановительных реакциях, которые происходят между металлами и кислотами. Эти реакции имеют большую практическую значимость и активно используются в различных сферах, начиная от химической промышленности и заканчивая повседневной жизнью.
Окислительно-восстановительные реакции – это процессы, сопровождающиеся переходом электронов от одного вещества к другому. В реакции металла с кислотой металл окисляется, отдавая электроны, а кислота восстанавливается, принимая эти электроны. Таким образом, происходит образование соединения металла с кислородом, а также выделение водорода.
Реакция металла с кислотой обычно сопровождается эффектом выделения газа. В зависимости от реагентов, могут образовываться различные продукты реакции. Например, если металл реагирует с соляной кислотой (HCl), то образуется хлорид металла и выделяется водородный газ. Если же металл реагирует с серной кислотой (H2SO4), то получается сульфат металла и также выделяется водород.
Что такое окислительно-восстановительные реакции?

Окислительно-восстановительные реакции (ОВР) являются одним из основных типов химических реакций. Они возникают в результате обмена электронами между веществами и являются проявлением изменения степеней окисления атомов в реагирующих веществах.
ОВР состоят из двух параллельных процессов: окисления и восстановления. Окисление - это процесс потери электронов веществом, при этом степень окисления атома увеличивается. Восстановление - это процесс приобретения электронов веществом, что приводит к уменьшению степени окисления атома.
Окислительно-восстановительные реакции играют важную роль в жизни и технологических процессах. Они определяют множество химических превращений, таких как горение, ржавление, коррозия металлов, процессы питьевой воды, производство электричества и др.
ОВР могут быть обратимыми и необратимыми. Обратимые ОВР могут протекать в обе стороны, то есть вещества могут окисляться и восстанавливаться. Необратимые ОВР происходят только в одном направлении.
Для описания ОВР принято использовать понятие "окислительно-восстановительная система" (ОВС). ОВС состоит из двух полуреакций - окисления и восстановления, которые происходят независимо друг от друга, но при этом взаимно связаны электронным обменом.
Окислительно-восстановительные реакции являются фундаментальными для понимания многих процессов в природе и технике. Изучение ОВР позволяет получить глубинные знания о механизмах химических реакций и их влиянии на окружающую среду.
Определение и примеры

Реакция металла с кислотой - это окислительно-восстановительная реакция, при которой металл вступает во взаимодействие с кислотным раствором, образуя соль и выделяя водород.
Примером такой реакции может служить реакция цинка с соляной кислотой:
Zn + 2HCl → ZnCl2 + H2
В этом уравнении цинк (Zn) взаимодействует с соляной кислотой (HCl) и образует хлорид цинка (ZnCl2) и молекулы водорода (H2), которые выделяются в виде пузырьков газа.
Другой пример - реакция железа с серной кислотой:
Fe + H2SO4 → FeSO4 + H2
В этом случае железо (Fe) реагирует с серной кислотой (H2SO4) и образует сульфат железа (FeSO4) и молекулы водорода (H2), которые также выделяются в виде газа.
Реакция металлов с кислотой

Реакция металлов с кислотой является типичным примером окислительно-восстановительной реакции. В результате этой реакции происходит выделение водорода и образование соответствующих солей металлов.
Во время реакции обычно происходит окисление металла и восстановление протона водорода. Металл, отдавая электроны, окисляется до положительного иона, а протон водорода, принимая электроны, восстанавливается до атомарного состояния. Это является основным механизмом реакции.
Скорость реакции металлов с кислотой зависит от их электрохимической активности. Наиболее активные металлы, такие как калий и натрий, реагируют очень быстро и агрессивно, при этом выделяя большое количество газа. Менее активные металлы, например, железо или медь, реагируют медленнее и спокойнее.
Реакция металлов с кислотами широко применяется в промышленности для получения различных продуктов, таких как металлосодержащие соли, водород и т.д. Эти реакции также изучаются в химическом образовании, так как помогают понять основы окислительно-восстановительных процессов и свойства металлов.
Причины реакции и ее химические уравнения

Реакция металла с кислотой является классическим примером окислительно-восстановительной реакции. Она происходит вследствие взаимодействия активного металла с кислотой, в результате чего возникает образование солей и выделение водорода.
Окислительно-восстановительная реакция представляет собой процесс, при котором происходит передача электронов между реагентами. В данном случае металл, выступающий в роли восстановителя, отдает электроны кислороду из кислоты, тем самым окисляясь. Кислород же восстанавливается, принимая электроны от металла.
Простейшим примером такой реакции является реакция цинка с соляной кислотой:
Zn + 2HCl → ZnCl2 + H2
В данном уравнении цинк (Zn) вступает в реакцию с соляной кислотой (HCl), образуя хлорид цинка (ZnCl2) и высвобождая молекулы водорода (H2).
Другим примером может служить реакция железа с серной кислотой:
3Fe + 8H2SO4 → Fe2(SO4)3 + 4H2O + SO2
В результате этой реакции образуется сульфат железа (Fe2(SO4)3), вода (H2O) и сернистый газ (SO2).
Такие реакции на практике применяются, например, для получения различных ценных веществ, таких как соли металлов или водород, а также используются в производстве батареек и других электрохимических устройствах.
Влияние реакции на окружающую среду

Реакция металла с кислотой является окислительно-восстановительной реакцией, которая может иметь существенное влияние на окружающую среду. Во-первых, при такой реакции может выделяться значительное количество газа, что может вызвать загрязнение атмосферы. Например, при реакции металла с сильной кислотой, такой как серная или соляная, образуется обильное количество вредных газов, включая сернистый газ (SO2) или хлороводород (HCl).
Кроме того, при взаимодействии металла с кислотой может происходить выделение токсичных и опасных веществ, которые могут попадать в окружающую среду и причинять вред как живым организмам, так и экосистемам. Например, медь, которая реагирует с различными кислотами, может образовывать токсичные соли меди, которые могут накапливаться в почвах и загрязнять водные ресурсы.
Реакция металла с кислотой может также приводить к изменению pH окружающей среды. Например, реакция с кислотами может приводить к снижению pH водных систем и создавать неблагоприятные условия для различных организмов, так как они могут быть чувствительны к изменению кислотности окружающей среды. Это может привести к нарушению экосистем и снижению разнообразия видов живых организмов.
Таким образом, реакция металла с кислотой имеет значительное влияние на окружающую среду. Она вызывает выброс газов, образование токсичных и опасных веществ, а также изменение pH окружающей среды. Поэтому необходимо принимать меры для контроля и предотвращения негативных последствий таких реакций, а также разрабатывать более экологически безопасные методы обработки и утилизации металлических отходов.
Применение окислительно-восстановительных реакций

Окислительно-восстановительные реакции широко используются в различных областях науки и промышленности. Они играют важную роль в химическом синтезе, анализе веществ, электрохимии и других областях.
В химическом синтезе окислительно-восстановительные реакции позволяют получать большое количество различных соединений и продуктов. Они используются для получения реактивов, лекарственных препаратов, красителей и множества других веществ. Окислительно-восстановительные реакции активно применяются в органическом синтезе и металлургии для получения различных органических соединений и металлов.
Окислительно-восстановительные реакции имеют важное значение в анализе веществ. Они позволяют определить содержание определенных веществ и степень окисления-восстановления в реакционной среде. Эти реакции используются в аналитической химии для определения концентрации и качественного состава различных веществ в различных образцах.
В электрохимии окислительно-восстановительные реакции играют ключевую роль. Они позволяют преобразовать химическую энергию в электрическую с помощью электрохимических элементов и аккумуляторов. Эти реакции используются в процессах электролиза, синтеза электрохимических элементов, гальванических покрытиях и других электрохимических процессах.
В промышленности окислительно-восстановительные реакции применяются для получения энергии, производства различных химических соединений и материалов. Они используются в производстве энергии в различных типах электростанций, в производстве стали и других металлов, в процессах переработки и утилизации отходов, а также в получении различных химических продуктов, таких как удобрения, пластмассы и другие вещества.
Основные этапы реакции металла с кислотой
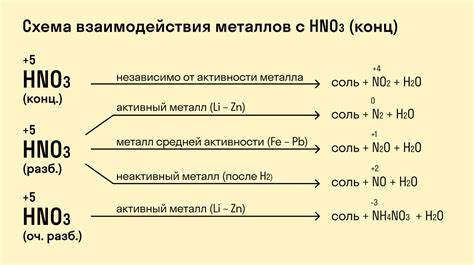
Реакция металла с кислотой является одним из основных примеров окислительно-восстановительных реакций. Она происходит в несколько этапов, каждый из которых имеет свою специфику и результат.
На первом этапе происходит образование водорода. В результате реакции металла с кислотой, металл отдает свои электроны кислоте, образуется положительно заряженный ион металла и отрицательно заряженный ион кислоты. После этого ионы соединяются, формируя молекулу водорода (H2). Это обычно сопровождается выделением пузырьков газа.
На следующем этапе происходит образование соли. Высвободившийся ион металла реагирует с ионами кислоты, образуя соль. Соль образует кристаллическую решетку и является электролитом. В зависимости от типа кислоты и металла, соль может быть безводной или гидратированной.
Также в процессе реакции может происходить образование основания. Некоторые металлы при реакции с кислотой образуют основание и соль, при этом выделяется вода. Образование основания связано с тем, что некоторые кислоты включают в себя воду, и металл может среагировать не только с кислотными ионами, но и с водой, образуя соответствующее основание.
Как безопасно проводить реакцию металла с кислотой

Реакция металла с кислотой является одной из наиболее распространенных химических реакций, которая может сопровождаться выделением газов и повышением температуры. Поэтому при проведении таких реакций необходимо соблюдать определенные меры безопасности, чтобы избежать возможных несчастных случаев и травмирования.
В первую очередь, перед началом работы необходимо надеть защитные очки, резиновые перчатки и халат, чтобы защитить глаза и кожу от попадания кислоты. Также рекомендуется работать в хорошо проветриваемом помещении или под вытяжкой, чтобы избежать вдыхания вредных паров.
Для безопасного проведения реакции металла с кислотой следует выбирать правильные пропорции и виды реагентов. Рекомендуется использовать разбавленные кислоты, чтобы снизить их агрессивность и предотвратить возможные излишки. Также необходимо выбирать металл, который не является слишком реактивным и не может вызвать сильное разжижение кислоты.
Необходимо аккуратно добавлять металл в кислоту, избегая резких движений и брызг. Реакцию следует проводить в специальных реакционных емкостях, которые сделаны из материалов, устойчивых к кислотам. Придерживайтесь предосторожности и не приближайтесь к реакционной смеси слишком близко.
После окончания реакции необходимо тщательно промыть оборудование и инструменты, используемые при проведении эксперимента. Кислотные отходы необходимо утилизировать в соответствии с правилами и требованиями к безопасной обработке химических отходов.
Соблюдение этих простых мер безопасности поможет избежать возможных неприятных последствий при проведении реакции металла с кислотой и сделает работу более безопасной и эффективной.
Вопрос-ответ

Что такое окислительно-восстановительная реакция?
Окислительно-восстановительная реакция - это реакция, в которой происходит перенос электронов между веществами. В одной части реакции происходит окисление (потеря электронов), а в другой - восстановление (получение электронов).
Каковы основные принципы реакции металла с кислотой?
Основные принципы реакции металла с кислотой заключаются в том, что металл отдает электроны, а ионы кислоты принимают эти электроны. Это приводит к образованию ионов металла в растворе и выделению газа.
